De 10 soorten chemische elementen (verklaard en geclassificeerd)
Hoeveel chemische elementen moeten er in het universum bestaan? Deze vraag heeft nog een lange weg te gaan, aangezien wetenschappers van tijd tot tijd hun eigen kunstmatige chemische elementen creëren.
Waar we echter een antwoord op kunnen geven, is: hoeveel soorten chemische elementen moeten er bestaan, iets dat we hierna zullen ontdekken.
- Gerelateerd artikel: "De 11 soorten chemische reacties"
De soorten chemische elementen
In de natuur komen we allerlei stoffen tegen. Deze stoffen komen meestal niet in hun pure staat voor, maar zijn het resultaat van de combinatie van verschillende elementen of materialen die door verschillende reacties, processen en tijdsperioden aanleiding hebben gegeven tot allerlei soorten materie. Er is niets in het universum dat niet het resultaat is van de combinatie van atomen die tot verschillende soorten chemische elementen behoren, die we in de diepte zullen zien.
Laten we echter, voordat we kijken naar de soorten chemische elementen, een korte bespreking van de middelbare schoolwetenschap doen en onthouden wat chemische elementen zijn.
We noemen 'chemisch element' materie die is samengesteld uit hetzelfde type atoom, dat wil zeggen een stof die atomair zuiver is. Chemische elementen kunnen niet worden ontleed in eenvoudigere en worden geclassificeerd in het periodiek systeem van de elementen als zuivere materialen van het universum.
Maar let op! We moeten elementen niet verwarren met eenvoudige stoffen, omdat in bepaalde gevallen twee of meer atomen van hetzelfde element kunnen samenstellen moleculen die op verschillende manieren zijn gegroepeerd die ervoor zorgen dat sommige van de fysieke eigenschappen van het element in kwestie variëren, in deze gevallen de isotopen. Diamant en koolstof zijn bijvoorbeeld stoffen die zijn gemaakt van het chemische element koolstof (C). maar dat is op verschillende manieren georganiseerd en resulteert in twee totaal verschillende materialen.
Carl sagan Er stond dat we sterrenstof zijn dat op sterren reflecteert. Deze mooie zin is niet louter een metafoor, maar een wetenschappelijk feit. Chemische elementen worden, voor zover we weten, gevormd in sterren die het resultaat zijn van complexe fusie- en kernsplijtingsprocessen die steeds zwaardere elementen genereren, het resultaat van een proces genaamd nucleosynthese.
De meeste bekende elementen kunnen worden verkregen uit de natuur, spontaan gevonden of verbindingen vormend met andere elementen zoals uranium (U), koolstof (C), silicium (Si), zilver (Ag) of goud (Au). Andere daarentegen zijn vervaardigd in laboratoria zoals americium (Am), berkelium (Bk) of curium (Cm). Wat de methode ook is om het te verkrijgen of als het in de natuur aanwezig is, afhankelijk van zijn eigenschappen, zal het chemische element in kwestie een of ander gebruik hebben.
Op dit moment zijn er ongeveer 118 chemische elementen bekend, hoewel het een kwestie van tijd is voordat het periodiek systeem zich uitbreidt, rekening houdend met het feit dat de mens nieuwe elementen heeft kunnen maken.
- Mogelijk bent u geïnteresseerd in: "De 2 soorten elektriciteit (uitgelegd)"
De belangrijkste soorten chemische elementen
De belangrijkste soorten chemische elementen worden weergegeven in het periodiek systeem, een systeem van classificatie gemaakt door de Russische chemicus Dmitri Mendelejev (1834-1907) die de basis legde in 1869. Chemische elementen worden visueel geordend op basis van hun eigenschappen en kenmerken.
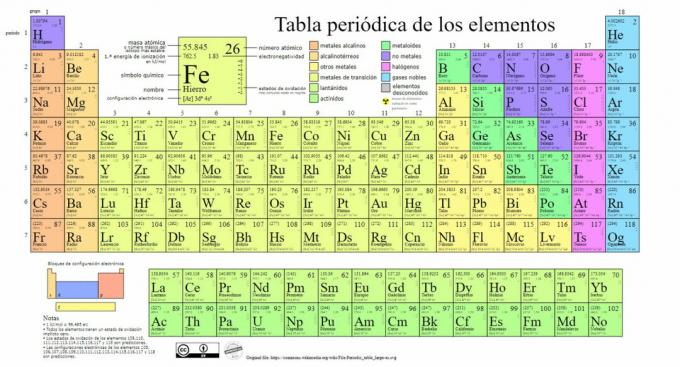
In de loop van de tijd en naarmate de scheikunde belangrijke wetenschappelijke ontdekkingen deed, zou deze tabel achtereenvolgens worden uitgebreid, het bereiken van de vorm die het vandaag heeft met de 118 elementen die tot nu toe bekend zijn.
Op dit moment kunnen we in deze tabel de volgende soorten chemische elementen vinden:
1. metalen
Metalen zijn chemische elementen die over het algemeen tussen één en drie elektronen in de laatste baan van hun atoom bevatten, elektronen die gemakkelijk kunnen worden overgedragen waardoor ze geleiders van warmte en elektriciteit worden.
Metalen zijn meestal kneedbaar en kneedbaar, met een karakteristieke glans waarvan de intensiteit afhangt van de beweging van de elektronen waaruit hun atomen bestaan. Meestal zijn metalen vast bij kamertemperatuur, behalve kwik.
Onder de metalen vinden we goud (Au), zilver (Ag), koper (Cu) en aluminium (Al) waarvan de fysieke kenmerken ze prachtige geleiders van elektriciteit maken, hoewel hun aanwezigheid in de natuur zeer gevarieerd is, weerspiegeld in het verschil tussen hun gewichten.
Er wordt aangenomen dat 75% van de chemische elementen die in de natuur voorkomen, metalen zijn, terwijl de resterende 25% zou bestaan uit edelgassen, metalloïden en andere soorten.
Er zijn classificaties binnen deze categorie, het vinden van actiniden, lanthaniden, overgangsmetalen, alkalimetalen, aardalkalimetalen en andere metalen.
- Gerelateerd artikel: "10 voedingsmiddelen met een hoog gehalte aan zink"
1.1. Lanthaniden
Lanthanide-elementen worden aangetroffen in afzettingen die uit veel mineralen bestaan. Het zijn witte metalen die gemakkelijk oxideren wanneer ze in contact komen met lucht. Onder hen vinden we Lanthaan (La), Promethium (Pm), Europium (Eu) en Ytterbium (Yb).

- Mogelijk bent u geïnteresseerd in: "De 5 soorten chemische bindingen: zo is materie samengesteld"
1.2. actiniden
Alle isotopen van actiniden zijn radioactief. Onder hen vinden we actinium (Ac), uranium (U), plutonium (Pu) en einsteinium (Es).
1.3. Overgangsmetalen
Overgangsmetalen bevinden zich in het centrale deel van het periodiek systeem. Het belangrijkste kenmerk is dat hebben elektronische configuratie van de "d" orbitaal gedeeltelijk gevuld met elektronen.
In deze groep zijn er allerlei soorten stoffen en volgens de breedste classificatie zou het overeenkomen met chemische elementen van 21 tot 30, van 39 tot 48, van 71 tot 80 en van 103 tot 112, zijnde een totaal van veertig en onder hen zouden we vanadium (V), ruthenium (Ru), zilver (Ag), tantaal (Ta) en lawrencio vinden (Lr).

1.4. Alkalimetalen
De alkalimetalen zijn een groep van zes elementen bestaande uit lithium (Li), natrium (Na), kalium (K), rubidium (Rb), cesium (Cs) en francium (Fr). Het zijn glanzende, zachte metalen, zeer reactief bij normale temperatuur en druk en verliezen gemakkelijk hun buitenste elektron, dat zich in hun "s"-orbitaal bevindt.
1.5. Alkalische aarden
De aardalkalimetalen zijn een groep elementen waarin we beryllium (Be), magnesium (Mg), calcium (Ca), strontium (Sr), barium (Ba) en radium (Ra) vinden. De naam komt van de naam die is gegeven aan zijn oxiden, "aarden", die basische of alkalische eigenschappen hebben.
Alkalische aarden ze zijn harder dan alkalisch, glanzen en zijn goede elektrische geleiders. Ze zijn minder reactief dan alkalische en werken als goede reductiemiddelen. Ze hebben het vermogen om ionische verbindingen te vormen en ze hebben allemaal twee elektronen in hun buitenste schil.

1.6. andere metalen
De categorie "andere metalen" is een soort stoffen die je hier vindt omdat je niet echt weet waar je ze moet plaatsen.
Het zijn metalen elementen die zich samen met de metalloïden in het p-blok in het periodiek systeem bevinden. Ze zijn meestal zacht met een laag smeltpunt. Onder hen zijn aluminium (Al), indium (In), tin (Sn) en bismut (Bi) onder anderen.

2. Geen metalen
Niet-metalen hebben over het algemeen tussen de vijf en zeven elektronen in hun laatste baan, een eigenschap die ervoor zorgt dat dat ze elektronen krijgen in plaats van ze op te geven en zo slagen ze erin om acht elektronen te hebben die ze zo stabiliseren als atomen.
Deze elementen het zijn zeer slechte geleiders van warmte en elektriciteit. Bovendien hebben ze geen karakteristieke glans, zijn ze niet erg kneedbaar, niet erg ductiel en zijn ze erg kwetsbaar in vaste toestand. Ze kunnen niet worden gerold of uitgerekt, in tegenstelling tot metalen.
Ze zijn meestal essentieel voor biologische systemen, omdat ze aanwezig zijn in de organische verbindingen, zoals zwavel (S), koolstof (C), zuurstof (O), waterstof (H) en jodium (ik).

- Gerelateerd artikel: "De 20 soorten edelstenen (beschreven en met foto's)"
3. Metalloïden
Zoals hun naam al doet vermoeden, zijn metalloïden: een tussenliggende classificatie tussen metalen en niet-metalen die eigenschappen van beide groepen hebben. Dit komt door het feit dat ze vier atomen in hun laatste baan hebben, een tussenhoeveelheid ten opzichte van die van metalen en niet-metalen.
Deze chemische elementen geleiden elektriciteit slechts in één richting, waardoor het niet in de tegenovergestelde richting kan gebeuren zoals bij metalen. Een voorbeeld hiervan vinden we in silicium (Si), een metalloïde die dankzij deze eigenschap wordt gebruikt bij de vervaardiging van halfgeleiderelementen voor de elektronica-industrie.
Andere metalloïden zijn: boor (B), arseen (As), antimoon (Sb) en polonium (Po).

4. Halogenen
Halogenen zijn een groep van zes elementen die: ze hebben de neiging om moleculen te vormen die zijn samengesteld uit twee atomen (diatomisch) die zeer chemisch actief zijn vanwege hun elektronegativiteit.
Deze stoffen verschijnen meestal in de vorm van ionen, dat wil zeggen elektrisch geladen moleculen, die in dit geval mononegatief en sterk oxiderend zijn. Dit betekent dat halogenen bijtende en bijtende stoffen zijn.
De halogenen zijn: fluor (F), chloor (Cl), broom (Br), jodium (I), astaat (At) en tenese (Ts).

5. Edelgassen
De edelgassen zijn een groep van zeven waarvan de natuurlijke staat gasvormig is. Ze verschijnen meestal in de vorm van diatomische moleculen met een zeer lage reactiviteit, dat wil zeggen dat ze niet reageren met andere elementen waaruit andere stoffen bestaan en om dezelfde reden staan ze bekend als inerte gassen. Dit komt omdat er in zijn laatste baan het maximale aantal elektronen mogelijk is voor dat niveau, acht in totaal.
Deze selecte groep elementen bestaat uit helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe), radon (Rn) en oganeson (Og), voorheen bekend als ununoctium.
