Utviklingen av den PERIODISKE TABELLEN: fra opprettelsen til i dag
Det periodiske systemet er et av mest ikoniske ikoner av vitenskapen. Selv om 2019 var 150-årsjubileet for opprettelsen, er det på ingen måte et ferdig dokument. I denne leksjonen fra en LÆRER vil vi se hva evolusjon av det periodiske systemet fra opprettelsen til i dag og hvilke fremskritt i kunnskapen om atomer og deres egenskaper har gjort det mulig.
Indeks
- Hva er det periodiske systemet?
- Første periodiske tabell: opprinnelsen
- Historien om det periodiske systemet og evolusjonen
Hva er det periodiske systemet?
De periodiske tabell Det periodiske elementsystemet er det vitenskapelige dokumentet som konsentrerer mer informasjon på mindre plass og utgjør et av de mektigste vitenskapene. Den inneholder en god del av kunnskap vi har om kjemi. Det er ikke noe lignende dokument i noen annen vitenskapelig disiplin.
Elementets periodiske system er a klassifiseringssystem for kjemiske elementer Det startet for mer enn 200 år siden. Dette klassifiseringssystemet har vokst og endret seg over tid etter hvert som vitenskapen utviklet seg og nye ble oppdaget.
kjemiske elementer. Imidlertid er de forskjellige modifikasjonene innlemmet og holder den grunnleggende strukturen intakt.Det periodiske systemet er så kalt fordi uttrykker grafisk måten de gjentar med jevne mellomrom, visse kjemiske egenskaper. Det er en type todimensjonal representasjon eller, i sine mer moderne representasjoner, tredimensjonal.
I klassisk periodisk bord (todimensjonal) de kjemiske elementene er ordnet i grupper eller familier og er representert i gjeldende periodiske tabell i vertikale kolonner. Det ordnede arrangementet av disse gruppene i kolonner gir opphav til en rekke rader, som kalles perioder, der elementene er ordnet i henhold til deres atomvekt. Det periodiske systemet består av syv perioder som varierer i lengde.

Første periodiske tabell: opprinnelsen.
Før Mendeleev hadde andre forskere utviklet klassifiseringssystemer for kjemiske elementer. Men, i motsetning til elementets periodiske system, var de det bare lister over kjente elementer; mens det periodiske systemet har den særegenheten at det er et klassifiseringssystem i to dimensjoner (rader og kolonner) eller tredimensjoner, i de mest moderne versjoner, der de kjemiske elementene er ordnet etter hverandre lag.
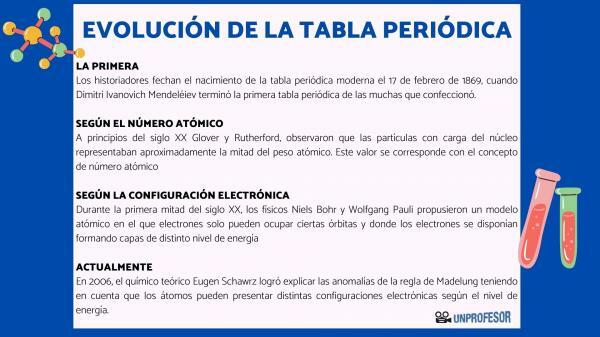
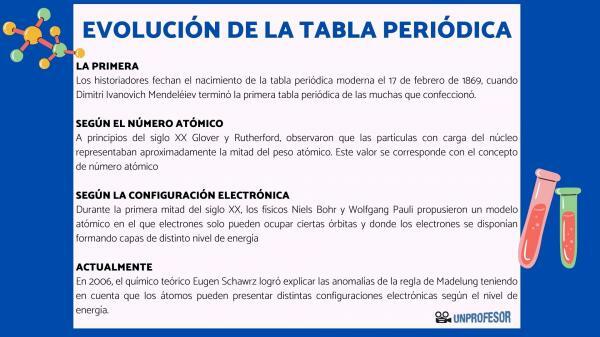
Av denne grunn daterer historikere fødselen av det moderne periodiske bordet 17. februar 1869, når Dimitri Ivanovich Mendeleev fullfør første periodiske systemet av de mange som han laget. Denne tabellen besto av 63 elementer ordnet i familier og etterlot tomme rom for elementer som ennå ikke var oppdaget, men hvorfra han hadde utledet deres atomvekt (som i tilfelle av Gallium, Germanium og Scandium)
Nøkkeldataene for oppdagelsen av det periodiske systemet var forkunnskaper om atomvekt av hvert element.
Hva er atomvekt og atomnummer?
Dette tallet representerte vekten av atomet og det var den eneste målbare verdien av atomer. Men det var ikke i noen tilfeller direkte målinger (det er ingen måleinstrumenter som tillater veiing av isolerte atomer), men de var et system som etablerte en standard der en vilkårlig verdi på 1 ble gitt til hydrogenatomet og verdien av atomvekten til de gjenværende elementene ble beregnet i forhold til dette Mønster.
De første beregningene av atomnummer av elementene ble utført av den engelske kjemikeren John dalton, og genererte en stor vitenskapelig debatt i løpet av første halvdel av 1800-tallet. I andre halvdel av 1800-tallet var det imidlertid allerede en bemerkelsesverdig enighet om systemet for beregning av atomvektene til elementene. Atomvekten ble fra Mendeleev og utover, et nøkkelkriterium for riktig rekkefølge av elementene i det periodiske systemet.
Da Mendeleev bestilte de kjente elementene i henhold til deres økende atomvekt, observerte utseendet på tilbakevendende egenskaper som gjorde at elementene kunne grupperes i grupper eller familier av elementer som var like hverandre. I noen tilfeller svarte imidlertid ikke rekkefølgen av elementene i henhold til deres atomvekt på likhetene mellom elementene som ble observert, og Mendeleev endret seg. posisjonen til 17 elementer i ordningen til det periodiske systemet til tross for atomvektene, for å kunne gruppere dem med de elementene de presenterte analogier med.
Disse endringene viste at noen av de aksepterte atomvektene ikke var korrekte og ble beregnet på nytt. Til tross for korreksjonene i atomvektene, var det fremdeles elementer som måtte plasseres i andre posisjoner enn de som er angitt av deres atomvekt.

Bilde: BBC.com
Historien om det periodiske systemet og evolusjonen.
Til tross for Mendeleevs utvilsomme bidrag, er det periodiske elementet ikke resultatet av en forskers arbeid. I tillegg til Mendeleev, i løpet av andre halvdel av det nittende århundre og gjennom det tjuende århundre mange Kjemikere fortsatte å undersøke den beste måten å organisere informasjon om kjemiske elementer på kjent. Enda mer med tanke på at i løpet av denne tiden oppdagelsen av nye kjemiske elementer eller enkle stoffertakket være spektrometri (som studerer samspillet mellom atomer og elektromagnetisk stråling).
De klassifisering av elementer i det periodiske systemet var opprinnelig basert på begynnelsesberegningene til atomvekter av elementene og avslørte analogier som gjorde at elementene kunne grupperes i analoge familier. Likevel kunne ikke årsaken til utseendet til disse periodiske egenskapene forklares. Det var gjennom hele 1900-tallet, med oppdagelsen av elektronisk struktur, da årsaken til denne periodisiteten i elementenes egenskaper ble forstått.
Atomtallet som en sorteringsrekkefølge
På begynnelsen av 1900-tallet Glover og Rutherford, observerte at de ladede partiklene i kjernen utgjorde omtrent halvparten av atomvekten. Denne verdien tilsvarer begrepet atomnummer som er definert som antall protoner i atomkjernen og som sammenfaller med antall elektroner i et nøytralt atom. Denne nye verdien begrunnet endringene i posisjonen til visse elementer som hadde blitt utført til da. For eksempel posisjonsendring mellom Tellurium og Jod.
I 1913, Henry Moseley bekreftet rekkefølgen av tabellen som en funksjon av atomnummer ved røntgenspektrometri. Bestillingen etter atomnummeret er fremdeles i kraft i dag.
På samme tid, i løpet av det 20. århundre, fortsatte nye kjemiske elementer å bli oppdaget takket være kvantemekanikk og utviklingen av teknikken til bombardement av atomer av partikler, fra andre halvdel av århundret. Med denne nye teknikken var det mulig å lage kunstige elementer som ikke er til stede i naturen.
Selv om det hadde blitt gjort fremskritt i riktig ordning av elementene i det periodiske systemet, fremdeles årsaken til at visse egenskaper (egenskapene periodisk). Utviklingen av kvantemekanikk (gren av fysikk som studerer oppførselen til lys og atomer i mikroskopisk skala) fra 1920 var avgjørende for å forklare årsaken til disse egenskapene.
Elektronisk konfigurasjon som forklaring på periodiske egenskaper
I løpet av første halvdel av det 20. århundre, fysikere Niels Bohr Y Wolfgang Pauli de foreslo en atommodell der elektroner bare kan okkupere bestemte baner og hvor elektronene er ordnet og danner lag med forskjellige energinivåer. Måten elektronene fordeler seg i orbitalene i de forskjellige skjellene eller energinivåene er kjent som elektronisk konfigurasjon.
Oppdagelsen av arrangementet av elektroner i elektronkonfigurasjoner var grunnleggende for å forstå egenskapens periodisitet. periodisk, siden det ble observert at disse egenskapene var nært beslektet med den ytterste elektroniske konfigurasjonen av atomene (laget av Valencia).
Rekkefølgen elektroner fyller atomorbitalene ble etablert i 1930 av fysiker Erwin Madelung som etablerte en numerisk regel for fyllingsrekkefølgen. Denne regelen er kjent som Madelung styrer og det er en empirisk regel som ikke kunne forklares ved hjelp av kvantemekanikk.
Fyllingssekvensen er enkel for de tre første radene i periodisk tabell, men i fjerde rad, der overgangselementene er plassert, gjennomgår fyllingsrekkefølgen en serie med endringer. Det er totalt 20 avvik som ikke følger denne regelen.
Utviklingen av bordet fortsetter i dag
I 2006, den teoretiske kjemikeren Eugen Schawrz Han klarte å forklare avvikene i Madelungs regel, med tanke på at atomer kan ha forskjellige elektroniske konfigurasjoner avhengig av energinivået. Når man beregner gjennomsnittene, samsvarer elektronkonfigurasjonene for de fleste elementene med Madelungs regel.
Det periodiske systemet fortsetter å være et spørsmål om debatt i det 21. århundre, selv om arrangementet eller den elektroniske konfigurasjonen av elementene, er det fortsatt gyldig å forklare denne rekkefølgen og avvikene som er observert i de elektroniske konfigurasjonene ved hjelp av en teori.
Hvis du vil lese flere artikler som ligner på Utviklingen av det periodiske systemet - sammendrag, anbefaler vi at du skriver inn vår kategori av Atomet.
Bibliografi
Ulike forfattere. (2019)Spesielt: det periodiske systemet. Forskning og vitenskap. Barcelona: Scientific Press S.A.

