De 10 typer kjemiske bindinger (forklart med eksempler)
Kjemiske bindinger er krefter som holder atomer sammen å danne molekylene. Det er tre typer bindinger mellom atomer:
- Metallisk binding.
- Jonisk bånd.
- Kovalent binding: ikke-polær, polær, enkel, dobbel, trippel, dativ.
Takket være disse bindingene dannes alle forbindelsene som finnes i naturen. Det er også krefter som holder molekyler sammen, kjent som intermolekylære bindinger, for eksempel:
- Hydrogenbindinger eller broer.
- Dipole-dipol krefter.
Deretter forklarer vi hver av disse koblingene.
| Typer kjemisk binding | Karakteristisk | Eksempler | |
|---|---|---|---|
| Metall | Metallioner flyter i et hav av bevegelige elektroner. | Metallelementer: natrium, barium, sølv, jern, kobber. | |
| Jonisk | Overføring av elektroner fra ett atom til et annet. | Na natriumklorid+Cl- | |
| Kovalent | Ikke polar | Del elektroner likt mellom to atomer. | Molekylært hydrogen H-H eller H2 |
| Polar | Del elektroner ujevnt mellom to atomer. | Vannmolekyl H2ELLER | |
| Enkel | Del et par elektroner. | Klormolekyl Cl2 Cl-Cl | |
| Dobbelt | Del to par elektroner. | Oksygenmolekyl O2 O = O | |
| Trippel | Del tre par elektroner. | Nitrogenmolekylet N≣N eller N2 | |
| Dativ | Bare ett av atomene deler elektronene. | Binding mellom nitrogen og bor i forbindelsen ammoniakk-bor trifluorid. | |
| Intermolekylære krefter | Hydrogenbro | Hydrogenene i ett molekyl tiltrekkes av de elektronegative atomer i et annet molekyl. | Hydrogen binder seg mellom hydrogenet i ett vannmolekyl og oksygenet i et annet vannmolekyl. |
| Dipole-dipole | Molekyler med to elektriske poler tiltrekker de motsatte polene til andre molekyler. | Interaksjoner mellom metanal H-molekyler2C = O |
Metallisk binding
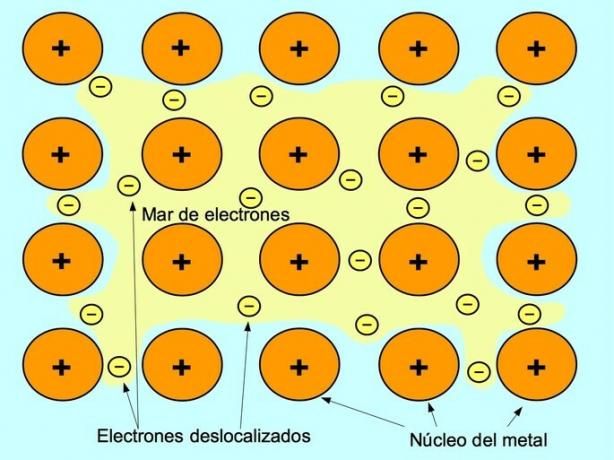
Den metalliske bindingen er tiltrekningskraften mellom de positive ionene til metallelementene og de negative elektronene som beveger seg fritt mellom ionene. Metallatomer er tett pakket, dette gjør at elektroner kan bevege seg i atomgitteret.
I metaller frigjøres valenselektronene fra sitt opprinnelige atom og danner et "hav" av elektroner som flyter rundt hele metallstrukturen. Dette får metallatomene til å transformere seg til positivt ladede metallioner som pakker sammen.
Den metalliske bindingen er etablert mellom metalliske elementer som natrium Na, barium Ba, kalsium Ca, magnesium Mg, gull Au, sølv Ag og aluminium Al.
Jonisk bånd
Den ioniske bindingen er kraften som forbinder et metallisk element, slik som natrium eller magnesium, med et ikke-metallisk element, slik som klor eller svovel. Metall mister elektroner og forvandles til et positivt metallion som kalles kation. Disse elektronene passerer til det ikke-metalliske elementet og det forvandles til et negativt ladet ion som kalles anion.
Kationene og anionene kombinerer og danner et tredimensjonalt nettverk som opprettholdes av kreftene for elektrostatisk tiltrekning mellom ionene med forskjellige ladninger. Disse kreftene danner ioniske forbindelser.
Jordskorpen består hovedsakelig av ioniske forbindelser. De fleste bergarter, mineraler og edelstener er ioniske forbindelser. For eksempel:
- Natriumklorid NaCl: det metalliske elementet er natrium som overfører et elektron til klor, som er det ikke-metalliske elementet.
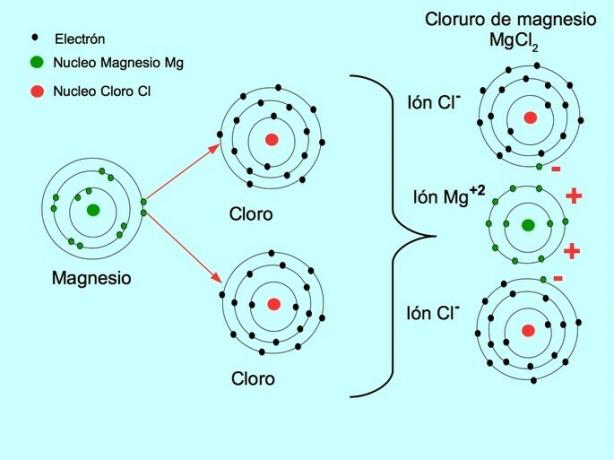
- Magnesiumklorid MgCl2: Magnesium Mg donerer to elektroner til to kloratomer, som vist i figuren nedenfor:
Se også Forskjell mellom kationer og anioner.
Kovalent binding
Den kovalente bindingen dannes når to ikke-metalliske atomer deler elektroner. Denne bindingen kan være av flere typer, avhengig av affiniteten til atomene og mengden av delte elektroner.
Ikke-polær kovalent binding
Den ikke-polære kovalente bindingen er bindingen som dannes mellom to atomer der elektroner deles likt. Denne bindingen forekommer normalt i symmetriske molekyler, det vil si molekyler som består av to like atomer, slik som hydrogenmolekylet H2 og oksygenmolekylet O2.

Polar kovalent binding
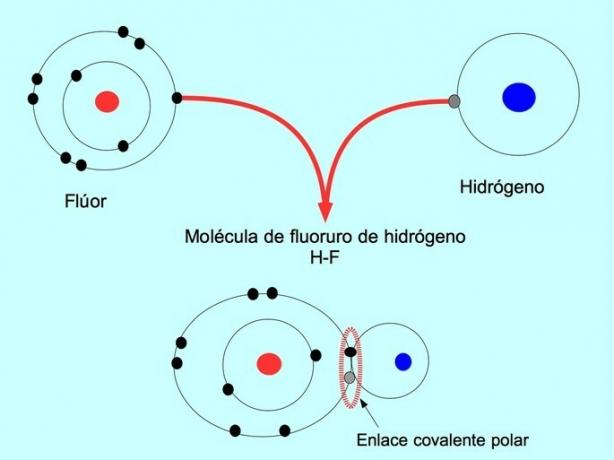
Den polare kovalente bindingen dannes når to atomer deler elektroner, men en av dem har større tiltrekningskraft for elektroner. Dette gjør at molekylet har en mer negativ "pol" med flere elektroner og den motsatte polen er mer positiv.
Molekyler med denne fordelingen eller ubalansen i elektroner er kjent som polare. For eksempel er det i hydrogenfluorid HF en kovalent binding mellom hydrogen og fluor, men fluor har høyere elektronegativitet, så det tiltrekker seg elektroner sterkere delt.
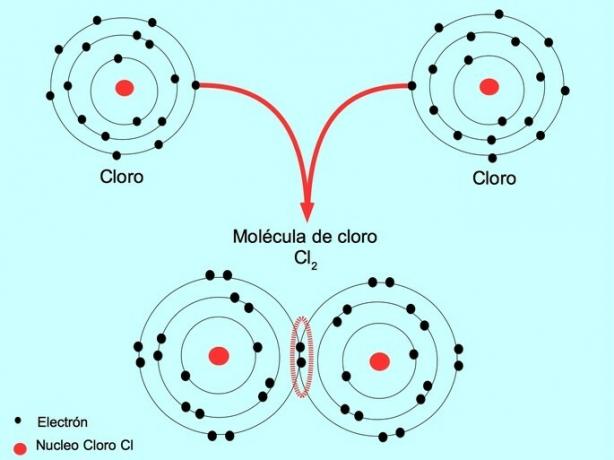
Enkel kovalent binding
Når to atomer deler to elektroner, ett fra hver, kalles den dannede kovalente bindingen en enkelt kovalent binding.
For eksempel er klor et atom som har syv valenselektroner i det ytre skallet, som kan fylles med åtte elektroner. Et klor kan kombineres med et annet klor for å danne klormolekylet Cl2 som er mye mer stabilt enn klor alene.
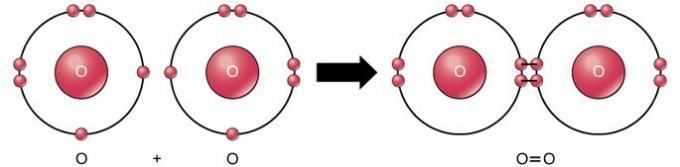
Dobbelt kovalent binding
Den doble kovalente bindingen er bindingen der fire elektroner (to par) elektroner deles mellom to atomer. For eksempel har oksygen 6 elektroner i sitt siste skall. Når to oksygener kombineres, deles fire elektroner mellom de to, noe som får hver til å ha 8 elektroner i det siste skallet.
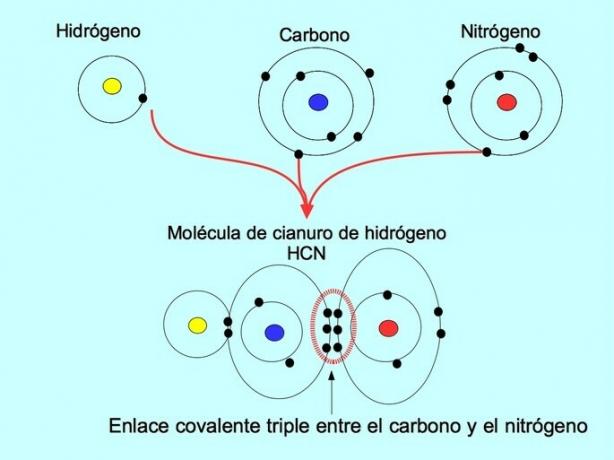
Trippel kovalent binding
Den tredobbelte kovalente bindingen dannes når 6 elektroner (eller tre par) deles mellom to atomer. For eksempel i hydrogencyanidmolekylet HCN dannes en trippelbinding mellom karbon og nitrogen, som presentert i figuren nedenfor:
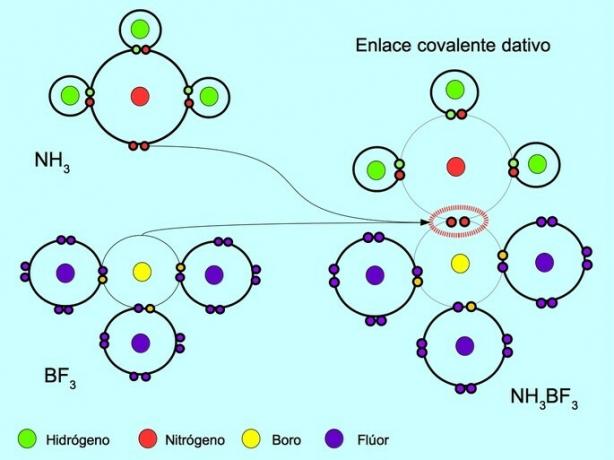
Koordinat eller dativ kovalent binding
Den koordinerte eller dative kovalente bindingen er bindingen som dannes når bare ett av atomene i bindingen bidrar med et par elektroner. For eksempel når ammoniakk NH reagerer3 med bortrifluorid BF3, Nitrogenbindinger med to elektroner direkte til bor, som ikke har noen elektroner tilgjengelig å dele. På denne måten sitter både nitrogen og bor igjen med 8 elektroner i valensskallet.
Se også Organiske og uorganiske forbindelser.
Intermolekylære lenker
Molekyler assosieres gjennom krefter som gjør det mulig å danne stoffer i flytende eller fast tilstand.
Dipol-dipolbindinger eller krefter
Svake intermolekylære bindinger kan etableres mellom polære molekyler når negative poler tiltrekkes av positive poler og omvendt. For eksempel metanal H2C = O er et polært molekyl, med en delvis negativ ladning på oksygen og en delvis positiv ladning på hydrogener. Den positive siden av et metanalmolekyl tiltrekker seg den negative siden av et annet metanalt molekyl.
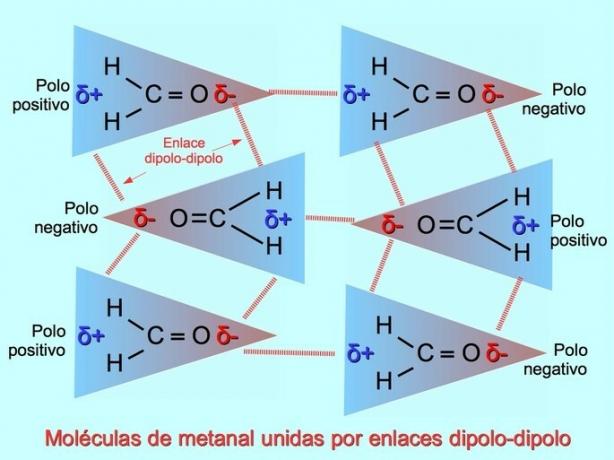
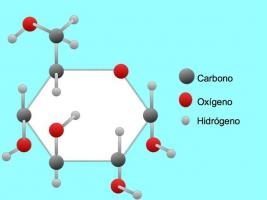
Hydrogenbindinger eller bindinger
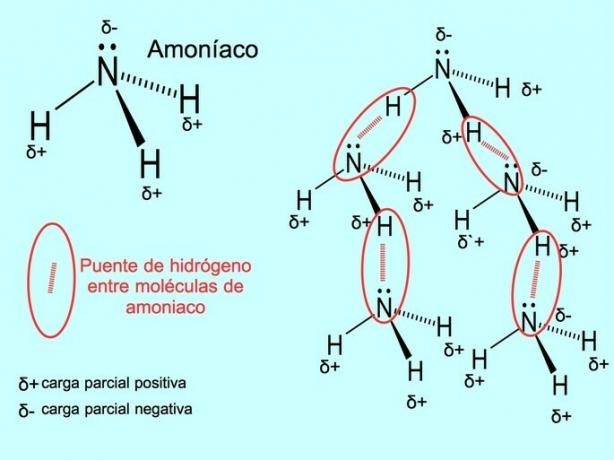
Hydrogenbindingen eller hydrogenbindingen er en binding som er etablert mellom molekyler. Det oppstår når et hydrogen i molekylet er kovalent bundet til et oksygen, et nitrogen eller et fluor. Oksygen, nitrogen og fluor er atomer med høyere elektronegativitet, derfor tiltrekker de elektroner sterkere når de deler dem med et annet mindre elektronegativt atom.
Det er hydrogenbindinger mellom vannmolekyler H2O og ammoniakk NH3 som bildet viser:
Du kan være interessert i å se:
- Atomer og molekyler.
- Eksempler på organiske og uorganiske forbindelser.
- Metaller og ikke-metaller
Referanser
Zumdahl, S.S., Zumdahl, S.A. (2014) Kjemi. Niende utgave. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5. utgave. Pearson Australia. Melbourne.