Forskjellen mellom sterke og svake syrer og baser (med eksempler)
En klassifisering av syrer og baser i kjemi avhenger av ioniseringskraften til disse stoffene i vandig medium. A) Ja:
- en syre og en base er sterke når de er fullstendig ioniserte, det vil si i ioniseringsprosessen blir de fullstendig transformert til kationer eller positive ioner og til anioner eller negative ioner.
- På den andre siden, en syre og en base er svake når de er delvis ionisert i vann, det vil si i oppløsning vil det være en andel av kationer, en annen andel av anioner og en annen andel av usosierte molekyler.
| Sterke syrer og baser | Svake syrer og baser | |
|---|---|---|
| Definisjon | Stoffer som fullstendig ioniserer i oppløsning. | Stoffer som delvis ioniserer i oppløsning. |
| Ionisering | Fullstendig | Delvis |
| Elementer i vandig løsning | Kationer og anioner i samme konsentrasjon. | Kationer, anioner og molekyler i forskjellige proporsjoner. |
| Ioniseringskonstant | Forhøyet | Litt |
| Eksempler |
|
|
Sterke syrer og baser
EN syre eller en base er sterke når de i et vandig medium dissosierer heltMed andre ord er ioniseringsprosessen fullført, og løsningen vil inneholde den samme konsentrasjonen av anioner og kationer.
Hvordan ioniserer du en syre og en sterk base?
En sterk syre, slik som saltsyre HCl, ioniserer på følgende måter:
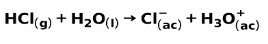
En sterk base, slik som natriumhydroksyd NaOH, ioniserer på følgende måter:
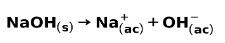
Eksempler på sterke syrer og deres formler
| Sterke syrer | Formel |
|---|---|
| Saltsyre | HCl |
| Svovelsyre | H2SW4 |
| Salpetersyre | HNO3 |
| Hydrobromic acid | HBr |
| Perklorsyre | HClO4 |
| Kromsyre | H2CrO4 |
| Tetrafluroborinsyre | HBF4 |
Eksempler på sterke baser og deres formler
| Sterk base | Formel |
|---|---|
| Natriumhydroksid | NaOH |
| Litiumhydroksid | LiOH |
| Kaliumhydroksyd | KOH |
| Rubidiumhydroksid | RbOH |
| Cesiumhydroksid | CsOH |
| Kalsiumhydroksid | Ca (OH)2 |
| Bariumhydroksid | Ba (OH)2 |
| Strontiumhydroksid | Sr (OH)2 |
| Aluminiumhydroksid | Al (OH)3 |
Du kan være interessert i å se mer eksempler på syrer og baser.
Svake syrer og baser
EN Syre eller base er svak når den er delvis ionisert i vandig oppløsning, det vil si i løsningen er det ioner og ikke-ioniserte molekyler.
Hvordan ioniserer du en syre og en svak base?
En svak syre, slik som eddiksyre CH3COOH, ioniseres på følgende måte:
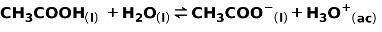
Likevekten til denne reaksjonen uttrykkes av de to pilene i motsatt retning.
Når en svak syre dissosieres eller ioniseres, opprettes en likevekt mellom artene som er tilstede i løsningen; dette kan uttrykkes av a ioniseringskonstantsur:
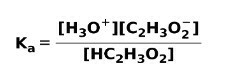
Ioniseringskonstanten er ikke noe mer enn forholdet mellom multiplikasjonen av konsentrasjonen av produktene over multiplikasjonen av konsentrasjonen av reaktantene.
En svak base, som NH ammoniakk3, ioniseres på følgende måte:
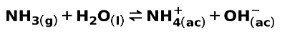
Når en svak base dissosieres eller ioniseres, etableres en likevekt mellom artene som er tilstede i løsningen; dette kan uttrykkes av a base ioniseringskonstant:
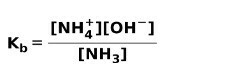
Du kan være interessert i å vite forskjellen mellom Syrer og baser.
Eksempler på svake syrer med formel og syreioniseringskonstant Ktil
| Svak syre | Formel | Ioniseringskonstant |
|---|---|---|
| Myresyre | H2CO2 | 1,77 x 10-4 |
| Eddiksyre | H3CCOH | 1,75 x 10-5 |
| Hydrocyanic syre | HOCN | 3,30 x 10-4 |
| Hydrogencyanid | HCN | 6,20 x 10-10 |
| Hypoklorsyre | HOCl | 3,50 x 10-8 |
| Salpetersyre | HNO2 | 4,00 x 10-4 |
| Melkesyre | HC3H5ELLER3 | 1,40 x 10-4 |
| Karbonsyre | H2CO3 |
4,30 x 10-7 5,60 x 10-11 |
| Borsyre | H3BO3 |
5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Eksempler på svake baser med formel og grunnleggende ioniseringskonstant Kb
| Svak base | Formel | Ioniseringskonstant |
|---|---|---|
| Ammoniakk | NH3 | 1,75 x 10-5 |
| Metylamin | CH3NH2 | 4,38 x 10-4 |
| Etylamin | C2H5NH2 | 5,60 x 10-4 |
| Aniline | C6H5NH2 | 3,80 x 10-10 |
| Pyridin | C5H5N | 1,70 x 10-9 |
| Benzylamin | C7H9N | 2,20 x 10-5 |
| Natrium bikarbonat | NaHCO | 2,00 x 10-4 |
Du kan være interessert i å vite mer om Kjennetegn ved syrer og baser