Kjennetegn ved syrer og baser: hovedforskjellene
Egenskapene til syrer og baser er alle de egenskapene og kvalitetene som vi kan skille mellom en syre og en base.
I følge Arrehnius teori, a syre er et stoff som frigjør protoner H+ når den er oppløst i vann, og a utgangspunkt er et hvilket som helst stoff som frigjør hydroksylioner OH- når den er i vandig løsning.
| Syrer | Baser | |
|---|---|---|
| Ionedannelse | Tilstede | Tilstede |
| Nøytraliseringsreaksjon | Når det reagerer med en base. | Når det reagerer med en syre. |
| Vannløselighet | Løselig | Delvis løselig. Kalsium, barium og aluminiumhydroksider er lite løselige. |
| Elektrisk ledningsevne | Tilstede | Tilstede |
| Når det gjelder | Fast, flytende eller gassformig | Fast, flytende eller gassformig |
| Reaksjon med lakmuspapir | Rød fargelegging | Blå fargestoffer |
| PH verdi | Under 7 år | Større enn 7 |
| Konjugert motstykke | En svak syre danner en konjugatbase. | En svak base danner en konjugert syre. |
| Etsende effekt | Sterke syrer | Sterke baser |
Kjennetegn ved syrer
Syrer har flere egenskaper som de kan identifiseres med.
Evne til å danne ioner fra syrer
De viktigste egenskapene til sure stoffer er at de kan ioniseres, det vil si miste eller få elektroner.
Saltsyre HCl, en sterk syre, ioniserer for å danne kloridanion Cl- og proton H+.
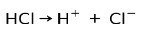
Nøytraliseringsreaksjon
En syre reagerer med en base for å danne salt og vann. Denne reaksjonen er kjent som nøytraliseringsreaksjon. For eksempel reagerer HCl med NaOH og danner natriumklorid NaCl (kjøkkensalt) og vann:
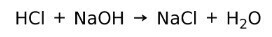
Vannløselighet av syrer
Syrer er vanligvis løselige i vann. For eksempel er saltsyre eller muriatsyre moderat løselig i vann, opptil 82 g HC1 kan oppløses i 100 ml vann ved 0 ° C. Når det gjelder svovelsyre H2SW4blandingen med vann genererer varme, så det anbefales alltid å tilsette syren til vannet for å unngå eksplosjoner.
Syrestyrke
Hvordan syrer dissosierer avgjør om de er sterke eller svake. Styrken til en syre er gitt av dens dissosiasjonskonstant.
Salpetersyre HNO3 det er en sterk syre fordi den i vandig løsning ioniserer fullstendig til protoner og nitrationer:

Dette betyr at når vi legger til HNO3 i vann, når vi analyserer vannet finner vi bare H+ og nitrationer, og praktisk talt ingen HNO3.
I stedet er eddiksyre som finnes i eddik a svak syre, fordi bare en del av det er dissosiert:
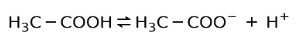
Derfor er den representert med piler i to retninger, dette betyr at i vandig løsning vil vi ha eddiksyre, H+ og acetatanionet (H3C-COO-).
Tilstander av materiens syrer
Syrer kan finnes i flytende, fast eller gassform. For eksempel er saltsyre HC1 flytende, hydrogensulfid HS er en gass, og oksalsyre er et fast stoff.
Reaksjon med lakmuspapir fra syrer

Når vi legger en stripe med lakmuspapir i et surt stoff, blir lakmuspapiret rødt.
Identifisering av syrer ved pH
PH er målet for mengden av H+ til stede i en løsning. Således, mellom pH 0 og 7, er vi i nærvær av en syre. For eksempel har eddik en pH lik 2, pH av svovelsyre i bilbatterier er lik 1.
Elektrisk ledningsevne av syrer
Siden syrer kan dissosiere og produsere elektrisk ladede ioner, kan sure løsninger lede strøm. For eksempel brukes bilbatterier, svovelsyre, som er en sterk syre, som en leder av elektrisitet.
Etsende effekt av sterke syrer
Sterke syrer har etsende effekt, de kan brenne organiske vev, så håndteringen må være ekstremt forsiktig.
Svake syrer danner et konjugert motstykke
Når det er oppløst, danner svake syrer det som er kjent som et konjugatpar, det vil si at en svak syre danner en konjugatbase.
For eksempel:

I dette tilfellet danner maursyre eller metansyre (HCOOH) det konjugerte baseionformatet når det er dissosiert.
Det kan interessere deg:
- Sterke og svake syrer og baser.
- Eksempler på syrer og baser.
Kjennetegn ved basene
Deretter presenterer vi egenskapene til basene eller de alkaliske løsningene som kjennetegner dem.
Base ioniseringskapasitet
Basiske eller alkaliske stoffer kjennetegnes ved å danne ioner når de er oppløst i vann:

I dette tilfellet ioniserer natriumhydroksydet NaOH til å danne et hydroksidanion OH- og en natriumkation Na+.
En base reagerer med en syre og danner et salt
En base reagerer med en syre i en nøytraliseringsreaksjon for å danne vann og et salt, for eksempel:

I dette tilfellet er aluminiumhydroksydet Al (OH)3, en base, reagerer med HCl og danner aluminiumkloridsaltet AlCl3 og vann. Aluminiumhydroksyd brukes som et syrenøytraliserende middel for å lindre gastrisk tilbakeløp ved å nøytralisere syren som produseres av magen.
Baserer vannløselighet
Noen baser er oppløselige i vann. Alkaliske jordhydroksider, slik som kalsiumhydroksid og bariumhydroksid, er dårlig løselige i vann. For eksempel kan natriumhydroksid eller kaustisk soda oppløses 109 g i 100 ml vann ved 20 ° C. Mens magnesiumhydroksid eller melk av magnesia Mg (OH)2 det er praktisk talt uløselig i vann.
Basestyrke
Avhengig av graden av ionisering av basen, kan disse være sterke eller svake. For eksempel er litiumhydroksyd a sterk base fordi den i vandig løsning ioniserer fullstendig til hydroksidioner OH og litium Li-kationer+:
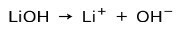
På den annen side, ammoniakk NH3 er en svak base fordi når det kommer i kontakt med vann, dissosierer ikke all ammoniakk:
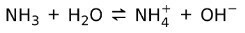
State of Matter of the Bases
Baser kan finnes i faste, flytende og gassformige tilstander. For eksempel er rent natriumhydroksid fast, ammoniakk er en gass.
Reaksjon med basenes lakmuspapir
Når vi legger en stripe med lakmuspapir i et alkalisk stoff, blir papiret blått.
Identifisering av baser ved pH
Basene er preget av å ha en pH mellom 7 og 14.
 Elektrisk ledningsevne til basene
Elektrisk ledningsevne til basene
Basene på grunn av sin ioniseringskapasitet er gode ledere av elektrisitet. For eksempel brukes i alkaliske batterier kaliumhydroksid KOH som elektrisk leder.
Etsende effekt av baser
Sterke baser kan skade organisk vev. For eksempel er kjøkkenovnsrengjøringsmidler generelt sterke baser, og det anbefales alltid å håndtere dem med ekstrem forsiktighet, iført hansker og øyevern.
Svake baser danner en konjugert motstykke
De svake basene når de er oppløst, danner en konjugert motstykke, det vil si at en svak base danner en konjugert syre.
For eksempel tris- (hydroksymetyl) amino metan (OHCH2)3CNH2 er en svak base hvis konjugatsyre er (OHCH2)3CNH3+:
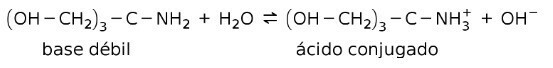
Dette er grunnlaget for virkningen av bufferstoffer eller buffer, som er stoffer som brukes til å opprettholde pH i løsninger konstant.
Du kan være interessert i å vite forskjellene mellom:
- Syrer og baser.
- Kationer og anioner