DEFINICJA jonów dodatnich lub ujemnych

Jak już wiemy, atomy są tworzone przez cząstki elementarne. Z trzech typów cząstek subatomowych tylko neutrony nie mają ładunku elektrycznego. Zamiast tego protony mają dodatni ładunek elektryczny, podczas gdy elektrony mają ładunek ujemny. Tylko elektrony, które zajmują obrzeże atomu, mogą być przenoszone z jednego atomu na drugi, podczas gdy protony w jądrze utrzymują swoją liczbę na stałym poziomie. W tej lekcji od NAUCZYCIELA zobaczymy, co się dzieje, gdy atomy lub cząsteczki zyskują lub tracą elektrony. To znaczy, zobaczymy definicja i przykłady jonów dodatnich lub ujemnych.
Indeks
- Czym są jony? Łatwa definicja
- Tworzenie jonów: elektropowinowactwo i elektroujemność
- Czym są jony ujemne? Z przykładami
- Czym są jony dodatnie? Z przykładami
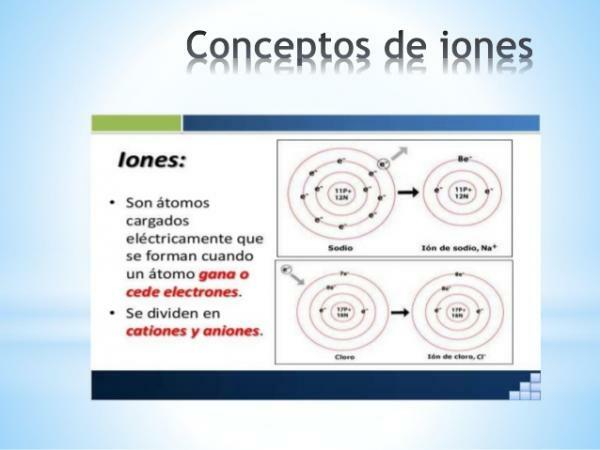
Czym są jony? Łatwa definicja.
ZA jon jest jakikolwiek atom lub cząsteczka z ładunkiem elektrycznym netto. Oznacza to, że jest to atom lub zbiór połączonych ze sobą atomów, których ładunki elektryczne nie są rekompensowane
. Ta dekompensacja ładunków występuje, gdy jeden lub więcej elektronów łączy się lub opuszcza atom lub zestaw atomów.Jony są więc naładowane atomy lub cząsteczki, ze względu na przyrost lub utratę elektronów (cząstki subatomowe o ładunku ujemnym i znikomej masie).
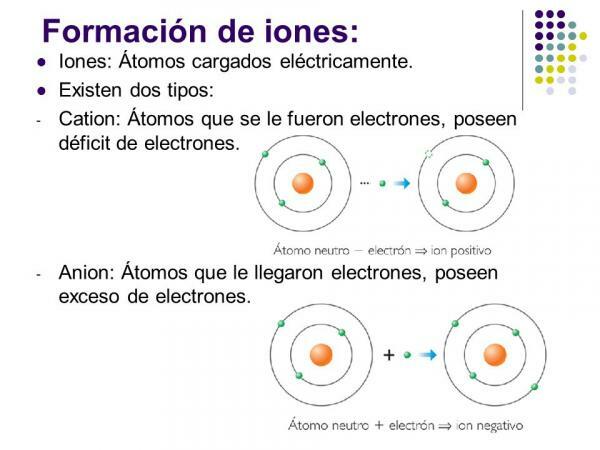
Typy jonów: jednoatomowe i wieloatomowe
Jeśli weźmiemy pod uwagę skład jonów, rozróżniamy dwa typy: jony jednoatomowe i jony wieloatomowe.
- Jak sama nazwa wskazuje, jony jednoatomowe te, które są tworzone przez a pojedynczy atom.
- Związki jonowe Jony polatomowe to te, w których atomy są związane kowalencyjnie (dzielą jedną lub więcej par elektronów w wiązaniu) prezentujące szereg neutrony w cząsteczce różna od całkowitej liczby elektronów.
- Jony polatomowe zazwyczaj zawierają tlen i zwykle mają strukturę z centralnym atomem, wokół którego ułożone są pozostałe elementy tworzące cząsteczkę.
- ładunek jonów jednoatomowych reprezentatywnych pierwiastków (rodziny 1 i 2 układu okresowego oraz rodziny 13 do 17 układu okresowego) można łatwo wywnioskować, jeśli znane jest ich położenie w układzie okresowym. W takich przypadkach atomy zyskują lub tracą elektrony, aby osiągnąć w swojej powłoce walencyjnej konfigurację gazu szlachetnego swojego okresu (s2p6) lub to samo, spełnij reguła oktetu.
Obraz: Udostępnianie slajdów
Tworzenie jonów: elektropowinowactwo i elektroujemność.
Zdolność atomów lub cząsteczek do tworzą jony określają dwie właściwości okresowe: elektropowinowactwo i elektroujemność. Obie właściwości zwiększają swoją wartość z upływem czasu i zmniejszają się, gdy przechodzimy przez grupę lub rodzinę układu okresowego.
elektropowinowactwo, zwana również powinowactwem elektronowym, jest właściwością atomową zdefiniowaną jako zdolność atomu do przyciągania elektronów. W przypadku związków podobna właściwość zwana elektroujemność który jest zdefiniowany jako zdolność atomu do przyciągania elektronów, gdy tworzy wiązanie z innym atomem. Obie właściwości definiują zatem tendencję elementu do wychwytywania lub utraty elektronów.
Wiązania jonowe
W postaci stałej jony tworzą związki lub kryształy jonowe (sole), utworzone przez kombinację jonów o różnym znaku połączonych ze sobą za pomocą wiązania jonowe. Najbardziej znanym przykładem tego typu związku jest sól kuchenna (chlorek sodu: NaCl).
Wiązanie jonowe składa się z połączenia jonów o różnym znaku za pomocą elektrostatycznych sił przyciągania (przyciąganie ładunków o przeciwnym znaku). W tego typu połączeniach ingerują elementy, których elektroujemność lub elektropowinowactwo jest bardzo różne (elementy metaliczne i niemetaliczne). W większości przypadków te związki jonowe są Rozpuszczalny w wodzie i inne rozpuszczalniki polarne.
W roztworach wodnych związki jonowe dysocjują na wolne jony, które nazywane są elektrolity, ponieważ jej obecność w roztworze sprawia, że woda zachowuje się jak przewodnik elektryczny.
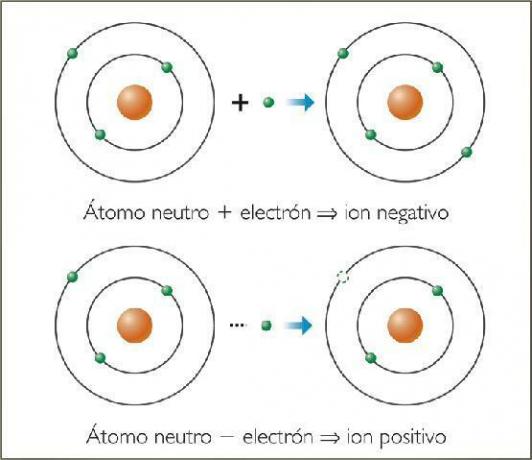
Czym są jony ujemne? Z przykładami.
jony ujemne Nazywają się aniony. We wszystkich przypadkach są to atomy pierwiastków niemetalicznych lub cząsteczki zawierające pierwiastki niemetaliczne. Elementy te charakteryzują się bardzo wysokim powinowactwem elektrycznym i elektroujemnością. Oznacza to, że są to jony utworzone przez pierwiastki z wysoka skłonność do wychwytywania elektronów.
Aniony jednoatomowe: definicja i przykłady
Są to aniony utworzone przez atomy pierwiastków niemetalicznych (grupy 13 do 17 układu okresowego), które uzyskały jeden lub więcej elektronów. Aniony te mają wspólną strukturę elektronową gazu szlachetnego (s2p6) w swojej najbardziej zewnętrznej powłoce elektronowej (powłoka walencyjna).
Przykłady:
- Jon chlorkowy: Cl-
- Jon fluorkowy: F-
- Jodek jonowy: I-
- Jon siarczkowy: S-2
- Jon azotkowy: N-3
Aniony wieloatomowe: definicja i przykłady
Są to jony naładowane ujemnie utworzone przez dwa lub więcej atomów pierwiastków niemetalicznych połączonych wiązaniami kowalencyjnymi. Są to najczęstsze jony wieloatomowe. Najczęstszymi anionami wieloatomowymi są oksoaniony, które składają się z niemetalicznego atomu centralnego i zawierają tlen.
Ogólnie uważa się je za związki chemiczne otrzymywane, gdy związek kwasowy traci jeden lub więcej protonów (H+). Te aniony wieloatomowe mogą zatrzymywać w swojej strukturze pewną ilość wodoru, co nadaje im pewien charakter kwasowy (zdolność do oddawania protonów).
Przykłady:
- Jon azotanowy: NO3-
- Jon nadmanganianowy: MnO4-
- Jon fosforanowy: PO4-3
- Jon wodorowęglanowy lub wodorowęglanowy: HCO3-
- Jon siarczynowy: SO3-2
Obraz: Naturopatia
Czym są jony dodatnie? Z przykładami.
Jony dodatnie nazywane są doacje. W prawie wszystkich przypadkach są to atomy pierwiastków metalicznych lub cząsteczki zawierające pierwiastki metaliczne. Pierwiastki te charakteryzują się bardzo niskim powinowactwem elektroenergetycznym i elektroujemnością, przez co wykazują wyraźną tendencję do utraty elektronów.
Kationy jednoatomowe: definicja i przykłady
Są to jony o ładunku dodatnim (z powodu utraty elektronów) utworzone przez pojedynczy atom pierwiastka metalicznego. W tym przypadku kation powstaje w wyniku utraty elektronów, które umożliwiają elementowi opróżnienie jego najbardziej zewnętrznej warstwy elektronicznej i uzyskanie konfiguracji gazu szlachetnego (s2p6) z niższego poziomu. Są najczęstszym rodzajem kationów.
Przykłady:
- Kation wodorowy lub wodorowy (zwany także protonem): H+
- Kation sodu: Na+
- Kation żelaza (III) lub kation żelaza: Fe+3
- Kation wapnia: Ca+2
- Miedź (II) lub kation miedziowy: Cu+2
Kationy wieloatomowe: definicja i przykłady
Kationy wieloatomowe to kationy utworzone przez dwa lub więcej atomów. Są rzadkie, najliczniej występują tzw. kationy homopoliatomowe, czyli takie, które zawierają więcej niż jeden atom tego samego pierwiastka, w przypadku jonu triwodorowego jest to jedna z najliczniejszych cząsteczek w wszechświat. Kationy wieloatomowe utworzone przez atomy różnych pierwiastków nie są powszechne, ale charakteryzują się obecność wodoru i uważa się, że powstaje, gdy zasadowy związek wychwytuje proton (H+).
Przykłady:
- Kation amonowy: NH4+
- Kation oksonium: HO3+
- Kation fosfonowy: PH3+
- Kation trójwodorowy lub protonowany wodór cząsteczkowy: H3+
- Kation dirtęciowy: Hg2+2
Obraz: Planety
Jeśli chcesz przeczytać więcej artykułów podobnych do Jony ujemne i dodatnie: definicja i przykłady, zalecamy wpisanie naszej kategorii Atom.
Bibliografia
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Angel Vázquez Segura. (2018) Chemia podstawowa. Madryt: Uned


