Odkryj, jak TABELA OKRESOWA jest zorganizowana w ŁATWY i PRAKTYCZNY sposób

Obraz: ptable.com
W 1869 r. rosyjski chemik Dymitr Iwanowicz Mendelejew wymyślił sposób na: sklasyfikować wszystkie pierwiastki chemiczne chemical które pojawiają się w naturze. Ta metoda klasyfikacji to układ okresowy pierwiastków i wielu opisuje ją jako „serce chemii”. Układ okresowy pierwiastków narodził się z zaledwie 63 pierwiastkami chemicznymi, ale jak zostały odkryte, do jego rzędów dodano liczne pierwiastki.
W tej lekcji od NAUCZYCIELA dokonamy przeglądu jak zorganizowany jest układ okresowy, sprawdzając, jakie kryteria są przestrzegane przy umieszczaniu różnych elementów w polach tej tabeli.
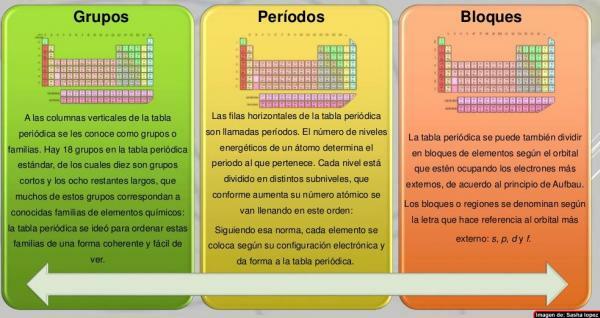
W kolumny układu okresowego nazwano je grupami. Obecnie w normalnie używanym układzie okresowym pierwiastków, czyli standardowym, znajduje się 18 grup, ponumerowanych od lewej do prawej od 1 do 18. Ten sposób nazywania grupy (nomenklatura) może być różna: czasami stosuje się mieszaną nomenklaturę cyfr i liter rzymskich, innym razem grupy mają nazwy zwyczajowe (metale zasady, halogeny, gazy szlachetne itp.), a w innych są one nazywane „grupą…” i nazwą jej pierwszego członka (na przykład „grupa skandu” dla grupy 3).
Elementy z tej samej grupy mogą mieć wzory o różnych właściwościach:
- Zwiększenie promienia atomowego, od góry do dołu w grupie. W miarę jak schodzimy do układu okresowego, wzrasta liczba elektronów, a tym samym liczba wypełnionych nimi powłok. Dlatego elektrony w ostatniej powłoce (powłoka walencyjna) są dalej od jądra, a atomy stają się coraz większe, czyli mają większy promień.
- Od góry każdy element ma niższa energia jonizacji. Ponieważ elektronów jest więcej, te znajdujące się w powłoce walencyjnej są dalej od jądra, a zatem Przyciąga je to z mniejszą siłą, ułatwiając usuwanie elektronów, gdy schodzimy w dół stołu. okresowy.
- Wreszcie obserwujemy również spadek elektroujemności w tej samej grupie. Ponownie, wraz ze wzrostem odległości między elektronami walencyjnymi a jądrem, elektrony innych atomów są dalej od siły przyciągania jądra i dlatego przyciąga je słabiej niż mniejsze atomy (grupy wyższy).
Te prawidłowości są trendami, to znaczy istnieją pewne wyjątki, takie jak to, co dzieje się w grupie 11, gdzie elektroujemność wzrasta w dalszej części grupy. Również w niektórych częściach układu okresowego, takich jak bloki d i f, poziome podobieństwa między pierwiastkami z tej samej grupy nie są tak zaznaczone.

Obraz: Biblioteka badawcza
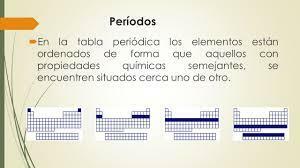
Siedem poziomych rzędów układu okresowego nazywa się okresy. Liczba poziomów energetycznych atomu określa okres, do którego należy. Każdy poziom jest podzielony na różne kategorie zwane powłokami lub orbitalami elektronicznymi, które mogą być typu s, p, d i f.
Podobnie jak to, co wydarzyło się w grupach, przedmioty z tego samego okresu mają podobne wzory promień atomowy, energia jonizacji, powinowactwo elektronowe i elektroujemność:
- W pewnym okresie promień atomowy zwykle spada, gdy przesuwamy się w prawo w układzie okresowym. Gdy przechodzimy od jednego pierwiastka do drugiego, dodawane są protony i elektrony, co powoduje, że pierwiastki elektrony są wciągane do jądra (pamiętaj, że elektrony są zbyt lekkie dla siły przyciągania) rdzeń).
- Spadek promienia atomowego w tym samym okresie sprawia, że energia jonizacji i elektroujemność wzrasta od lewej do prawej, ponieważ przyciąganie, jakie jądro wywiera na elektrony, wzrasta.
- Powinowactwo elektroniczne pokazuje również wzór w tym okresie, choć łagodniejszy. Metale znajdujące się po lewej stronie układu okresowego mają zwykle mniejsze powinowactwo niż niemetale znajdujące się po prawej stronie okresu. Jest to uogólnienie i nie dotyczy gazów szlachetnych, które mają wypełnioną ostatnią warstwę (warstwę walencyjną), a zatem są bardzo mało reaktywne.
Obraz: SlidePlayer
Elementy układu okresowego można podzielić w blokach zgodnie z kolejnością ukończenia powłok elektronowych pierwiastków. Każdy blok jest nazwany zgodnie z najnowszyorbital, w którym teoretycznie jest ostatni elektron (s, p, d lub f):
- Blok s Składa się z dwóch pierwszych grup, wodoru i helu.
- Blok p Składa się z sześciu ostatnich grup (grupy od 13 do 18).
- Zablokuj d Tworzą się grupy od 3 do 12 (powszechnie nazywane metalami przejściowymi).
- Blok f, który zwykle jest umieszczony oddzielnie, pod resztą układu okresowego pierwiastków, nie ma numerów grup i składa się z lantanowców i aktynowców.
Układ okresowy pierwiastków przetrwał tyle lat, ponieważ jest to system, który okazał się bardzo przydatny, a przede wszystkim dlatego, że można go aktualizować. Teoretycznie mogłoby być więcej pierwiastków, które wypełniłyby inne orbitale, ale te nie zostały jeszcze zsyntetyzowane lub nie zostały odkryte. W przypadku odkrycia nowych pierwiastków atomowych, naukowcy kontynuowaliby alfabetyczny opis nazw różnych bloków (blok g, blok h itd.).
Zdjęcie: Educando, portal edukacji dominikańskiej
