Różnica między reakcjami endotermicznymi a egzotermicznymi
ZA reakcja endotermiczna wymaga zasilania, gdy reakcja egzotermiczna uwalnia energię. Ta klasyfikacja reakcji chemicznych uwzględnia udział energii jako reagenta lub jako produktu.
Energia to zdolność do wykonywania pracy lub wytwarzania ciepła. Pamiętaj, że reakcje chemiczne polegają na reorganizacji atomów między substancjami z przerwaniem lub utworzeniem wiązań chemicznych. Na ogół temu tworzeniu lub zerwaniu wiązań chemicznych towarzyszą zmiany energii układu.
| Reakcja endotermiczna | Reakcja egzotermiczna | |
|---|---|---|
| Definicja | Reakcja chemiczna, w której energia jest pochłaniana. | Reakcja chemiczna, w której energia jest uwalniana w postaci ciepła. |
| Pochodzenie energii | Środowiska | Systemu |
| Energia potencjalna | Mniej reagentów niż produktów. | Więcej reagentów niż produktów. |
| Produkcja | Nie spontaniczny | Spontaniczny |
| Zmiana energii wewnętrznej | ΔE> 0; wewnętrzna zmiana energii większa od zera. | ΔE <0; wewnętrzna zmiana energii mniejsza od zera. |
| Temperatura | Zmniejsza | Zwiększa |
| Przykłady | Reakcje w fotosyntezie i syntezie w ogóle. | Płonąca zapałka, reakcje spalania. |
Czym jest reakcja endotermiczna?
Reakcja chemiczna jest endotermiczna, gdy pochłania energię z otoczenia. W takim przypadku ciepło przekazywane jest z zewnątrz do wnętrza systemu. Kiedy umieszczamy termometr w czasie, gdy zachodzi reakcja endotermiczna, temperatura spada.
Słowo „endotermiczny” pochodzi z języka greckiego endon co oznacza "wewnątrz" i terme co oznacza „ciepło”. Reakcje endotermiczne nie zachodzą spontanicznie.
Skąd pochodzi energia w reakcjach endotermicznych?
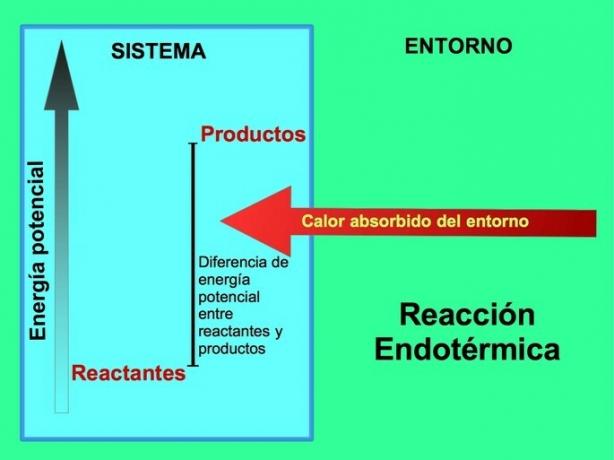
W reakcjach endotermicznych energia pochodzi ze środowiska poza systemem. Ilość energii potencjalnej produktów jest większa niż energia potencjalna reagentów. Dlatego wymagane jest dodanie energii do reagentów, aby reakcja mogła przebiegać. Ta energia pochodzi z ciepła otoczenia.
Na przykład, fotosynteza to proces endotermiczny, gdzie rośliny wychwytują energię słoneczną do produkcji glukozy z dwutlenku węgla i tlenu:

Produkty reakcji fotosyntezy, glukoza i tlen, mają większą ilość energii potencjalnej w stosunku do reagentów, dwutlenku węgla i wody. Inne przykłady endotermicznych reakcji chemicznych z ilością zużytej energii:

Przykłady reakcji endotermicznej
Reakcje zachodzą nie tylko w laboratorium chemicznym. Na co dzień znajdujemy również sytuacje, w których występują reakcje endotermiczne.
Gotowanie żywności
Chociaż może się na to nie wydawać, proces gotowania żywności jest endotermiczny. Aby spożywać określone pokarmy, musimy zapewnić ciepło.
Natychmiastowa zimna torba
Opakowania chłodzące stosowane w leczeniu guzów lub skręceń są wypełnione wodą, ale po wstrząśnięciu lub uderzeniu kapsułka zawierająca azotan amonu pęka do środka. Mieszanie azotanu amonu z wodą jest reakcją endotermiczną, powodującą ochłodzenie worka.
Możesz być zainteresowany zobaczeniem Różnica między ciepłem a temperaturą.
Czym jest reakcja egzotermiczna?
ZA reakcja egzotermiczna to taka, w której energia wypływa z układu. Energia ta jest uwalniana w postaci ciepła, więc umieszczenie termometru w układzie reakcyjnym powoduje wzrost temperatury.
Słowo „egzotermiczny” tworzy egzo co oznacza „na zewnątrz” i termy, co oznacza „ciepło”. Reakcje egzotermiczne mogą zachodzić spontanicznie, aw niektórych przypadkach mogą być wybuchowe, tak jak połączenie metali alkalicznych i wody.
Skąd pochodzi energia w reakcjach egzotermicznych?
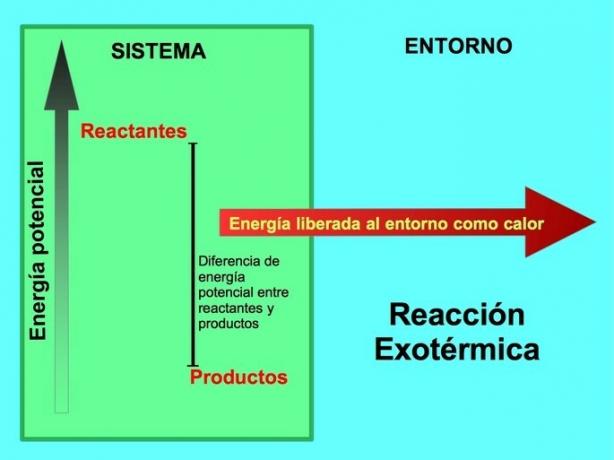
W reakcji chemicznej reagenty są związkami, które przekształcają się i tworzą produkty. Na przykład, gdy sód Na reaguje z chlorem Cl, są to reagenty, a produktem jest chlorek sodu NaCl:

Zarówno reagenty, jak i produkty przechowują energię potencjalną. Wiemy z loszczędzanie energii ta energia nie jest ani tracona, ani zyskiwana, więc energia reagentów musi być równa energii produktów.
W reakcji egzotermicznej lreagenty mają większą energię potencjalną w porównaniu do produktów, więc nadmiar energii jest uwalniany w postaci ciepła. W tym przypadku energia jest również uważana za część produktów:

W każdym procesie egzotermicznym część energii potencjalnej zmagazynowanej w wiązaniach chemicznych jest przekształcana w energię cieplną poprzez ciepło.
Przykłady reakcji egzotermicznej
Proszek do prania
Gdy rozpuścimy w dłoniach odrobinę detergentu w proszku wodą, możemy poczuć lekkie przegrzanie.
Domowe spalanie gazu
Spalanie gazów do użytku domowego, takich jak metan czy butan, obejmuje reakcję chemiczną z tlenem z wytworzeniem dwutlenku węgla i wody oraz uwolnieniem energii. To typowa reakcja egzotermiczna w codziennym użytkowaniu:
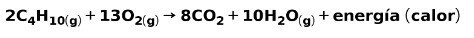
Energia uwalniana w procesie spalania jest wykorzystywana do gotowania potraw.
Możesz także chcieć wiedzieć, czym one są System otwarty, system zamknięty i system izolowany.



