Czym są WZORY CHEMICZNE i do czego służą [PODSUMOWANIE + WIDEO]
Chociaż nie wydaje się, pierwiastki chemiczne układu okresowego pierwiastków Otaczają nas ze wszystkich stron. Jednak wiele razy nie występują osobno, ale tworzą cząsteczki lub makrocząsteczki różnych pierwiastków chemicznych. Wzory chemiczne są graficznym wyrazem tych związków i są stosowane w celu ujednolicenia ich nazewnictwa. W tej lekcji od NAUCZYCIELA zobaczymy czym są wzory chemiczne i do czego służą. Dołącz do nas, aby dowiedzieć się więcej!
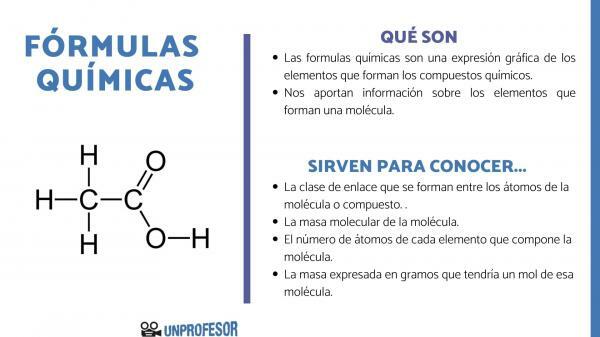
ten wzory chemiczne są graficznym wyrazem elementów składających się na związki chemiczne.
Te wzory chemiczne nie są arbitralne, ale są zgodne z niektórymi surowe zasady nomenklatury chemicznej, ustanowionej przez IUPAC (Międzynarodowe Zrzeszenie Chemii Czystej i Stosowanej).
Wzory chemiczne dostarczają nam również informacji o pierwiastki tworzące cząsteczkę, a więc na przykład informuje nas o liczbie i odpowiednich proporcjach każdego z tworzących go atomów, a czasami nawet o rodzaju Wiązanie chemiczne która istnieje pomiędzy tymi elementami.
Każda istniejąca cząsteczka lub makrocząsteczka odpowiada jej wzorowi chemicznemu, jednak istnieją różne rodzaje formuł. Każdy z tych typów dostarcza nam innych informacji o cząsteczce, ale wszystkie pomagają nam zrozumieć jej Natura chemiczna i pomaga nam zrozumieć, co dzieje się w reakcjach chemicznych i jak jeden związek może przekształcić się w inny.
Ale aby zrozumieć tę chemiczną nomenklaturę, konieczna jest pewna wiedza chemiczna, ponieważ są posłuszni dość wyspecjalizowanemu językowi technicznemu.

Obraz: odtwarzacz slajdów
ten wzory chemiczne są reprezentowane przez połączenie symboli chemicznych, z odpowiednią literą każdego atomu, która występuje w układ okresowy pierwiastkówi indeksy dolne, które są liczbami reprezentującymi ich ilość atomy w cząsteczce
W chemii (zarówno organicznej, jak i nieorganicznej) istnieją pewne fragmenty lub związki, które: wykazują pewną powtarzalność zarówno strukturalną, jak i funkcjonalną i są identyfikowane nazwami konkretny. Gdy te fragmenty mają wolne elektrony, które nie są współdzielone, nazywane są rodnikami i są niestabilnymi, wysoce reaktywnymi związkami o krótkim okresie półtrwania.
Przykładami rodników są grupy metylowe CH3, grupy azotanowe NO3, grupy hydroksylowe OH- lub rodnik Cl-. Są one jednak znane jako grupy funkcyjne, gdy są atomami lub grupami atomów przyłączonymi do łańcucha dwutlenek węgla (z różnym węglem) i które są odpowiedzialne za reaktywność i właściwości chemiczne Cząsteczki.
Grupy te są szczególnie ważne w chemii organicznej (biocząsteczki człowieka to zasadniczo węgiel i wodór). Kilka przykładów grup funkcyjnych są grupą karbonylową = C = O lub grupa karboksylowa -COOH.

Zdjęcie: Monogramas.com
Jak powiedzieliśmy, istnieje kilka rodzajów wzorów chemicznych. Każda z tych formuł daje nam inny rodzaj informacji o cząsteczkach, a zatem służy konkretnemu celowi, a żadna formuła nie jest lepsza lub gorsza od innej w ujęciu ogólnym.
Wyróżniamy klasy wzorów chemicznych:
Wzory empiryczne
Formuły empiryczne to najprostsze formuły reprezentujące cząsteczkę chemiczną, czasami mówiące, że są to formuły minimalne. Wzory te reprezentują proporcje atomów każdego z pierwiastków w cząsteczce, które są uproszczone do liczb całkowitych, zawsze najmniejszych. Przykładem tego wzoru jest CH3 (grupa metylowa), z trzema atomami wodoru i jednym atomem węgla.
Jednak te formuły mogą czasami dawać błędne wyobrażenia na temat składu cząsteczki. Dzieje się tak, gdy wzór nie wskazuje rzeczywistej liczby atomów w cząsteczce, jak w przypadku nadtlenku wodór, którego wzór empiryczny to HO, podczas gdy wzór powinien brzmieć H2O2 (dwa atomy wodoru i dwa tlen). Dzieje się to zatem poprzez konwencję nomenklatury, ponieważ oba indeksy są równe, są uproszczone.
Niektóre związki można jednak przedstawić tylko za pomocą wzorów empirycznych, ponieważ składają się z sieci jonowych. Dzieje się tak na przykład w soli kuchennej lub chlorku sodu, który jest przedstawiany jako NaCl, co wskazuje, że każdy sód jest chlorem.
Wzory molekularne
Tego typu formuły są dość podstawowe, po prostu wyrażają typ atomów i liczbę każdego z nich w cząsteczce kowalencyjnej. Są to wzory przedstawiające pierwiastki chemiczne i liczbę w sposób liniowy (w postaci indeksu dolnego). Przykładem tego typu formuły jest nazwa glukozy C6H12O6, która wyraża tę glukozę Cząsteczka glukozy składa się z sześciu atomów węgla, dwunastu atomów wodoru i sześciu tlen.
Wzory cząsteczkowe są szeroko stosowane, czasami mówiąc, że są to prawdziwe wzory cząsteczek. W wielu przypadkach pokrywają się one ze wzorami empirycznymi, np. w CO2.
Częściowo opracowane formuły
Formuły częściowo rozwinięte są rodzajem formuł podobnych do formuł molekularnych, ponieważ wyrażają również atomy tworzące cząsteczkę i ich liczbę, ale także podać informacje o wiązaniach chemicznych (reprezentowanych przez linie między atomami) oraz o rodzaju wiązania między tworzącymi je atomami węgla (jeśli są proste, podwójne lub trójki). Półrozwinięta formuła jest przydatna do identyfikacji rodników, które tworzą cząsteczkę i jej strukturę chemiczną (nie są reprezentowane wiązania między atomami węgla i wodoru).
W przypadku glukozy jej półrozwinięty wzór to CH2OH - CHOH - CHOH - CHOH -CHOH - CHO i jak widać atomy węgla, wodoru i tlen są takie same jak we wzorze cząsteczkowym (odpowiednio sześć, dwanaście i sześć) i wszystkie wiązania pojedyncze (glukoza ma tylko wiązania prosty). Formuła ta jest zatem formułą bardziej złożoną niż formuła cząsteczkowa.
Formuły częściowo rozwinięte są czasami nazywane skondensowanymi i są prawdopodobnie najszerzej stosowaną klasą formuł. stosowane, zwłaszcza w chemii organicznej, chociaż nie pozwalają na obserwację rzeczywistej geometrii cząsteczek.
Opracowana formuła
Opracowane formuły są nieco bardziej złożone niż te półopracowane. W tego typu wzorach wiązanie i położenie każdego atomu w cząsteczce są przedstawione na płaszczyźnie kartezjańskiej, dopóki nie zostanie przedstawiony cały związek.
Formuła strukturalna
Wzór strukturalny to graficzne przedstawienie struktury cząsteczki w przestrzeni, dające nam informacje o kolejności i rozmieszczeniu atomów w przestrzeni. W tym wzorze pokazane są również wiązania chemiczne, które tworzą cząsteczkę i czy są pojedyncze, podwójne czy potrójne. Ta formuła jest zatem tą, która daje nam najwięcej informacji o cząsteczce.
Tego typu formuły są częściej używane na profesjonalnym poziomie w świecie chemii, ponieważ pozwalają znacznie wyraźniej zobaczyć reakcje chemiczne lub syntezę nowych cząsteczek.
Wzory Lewisa
Są to złożone, bardzo specyficzne i techniczne formuły. Są one również znane jako diagramy lub struktury Lewisa i są podobne do opracowanych wzorów cząsteczek, ale Ponadto wskazano elektrony, które atomy mają udział w każdym wiązaniu chemicznym, które zmieniają się wraz z wartościowością atomów zaangażowany.
W tych wzorach wiązania między atomami są reprezentowane przez linie (wskazujące również, czy są pojedyncze, podwójne czy potrójne) lub przez parę kropek. Pojedyncze elektrony lub elektrony, które nie są wspólne w wiązaniu, są reprezentowane przez punkty wokół atomu, któremu odpowiada.

Obraz: Chemia organiczna
Podczas pisania formuł czasami odwołuje się doliczba utlenienia pierwiastka (występuje często w związkach jonowych). Jest to zestaw liczb dodatnich i ujemnych, które idą związane z każdym elementem.
- Liczby utlenienia można interpretować jako liczba elektronów że element ma udział w wiązaniu kowalencyjnym lub przenosi się w wiązaniu jonowym.
- Gdy znak utlenienia nad atomem to negatywny, oznacza, że pierwiastek ten wychwytuje elektrony, a liczba towarzysząca mu obok to liczba przechwyconych elektronów. Dlatego stopień utlenienia -1 oznacza, że pierwiastek odbiera jeden elektron, -2 odbiera dwa i tak dalej.
- Kiedy oznaką utleniania jest pozytywny, atom oddaje elektron, a liczba towarzysząca temu znakowi jest liczbą oddanych elektronów. Podobnie, stan utlenienia +1 oznacza, że daje jeden elektron, +2, że daje dwa i tak dalej.
Działa to głównie dla Związki jonowe, w wiązaniach kowalencyjnych, chociaż interpretacja jest podobna, nie jest taka sama, ponieważ te wiązania mają wspólne elektrony. W tych związkach mówimy o elementach elektroujemnych, które ciągną więcej pary elektronowej i mają bardziej ujemny ładunek, w zależności od liczby przyciąganych elektronów. Widać to w Wzory Lewisa.
Jeśli chcesz wiedzieć, do czego służą wzory chemiczne, musisz wziąć pod uwagę, że ta liczba pozwala nam uzyskać niektóre informacje o cząsteczkach, tak jak oni:
- ten klasa linków które powstają między atomami cząsteczki lub związku. Wiązania te są zwykle kowalencyjne, gdy uczestniczą w nim atomy niemetaliczne i jonowe, jeśli są to wiązania metaliczne i niemetaliczne.
- ten masa cząsteczkowa cząsteczki.
- ten liczba atomów każdego pierwiastka, który tworzy cząsteczkę. Czasami nazywa się to setną składem cząsteczki.
- Masa wyrażona w gramy który miałby jeden mol tej cząsteczki.
W przypadku związku jonowego, na przykład chlorku sodu lub soli kuchennej, nie jest to ściśle poprawne mówić o molekułach (chociaż czasami się to robi), że mają tendencję do tworzenia dużych agregatów i makrocząsteczki. W tym przypadku wzór związku pomaga nam zobaczyć, jakie jony go tworzą i w jakiej ilości.

