DEFINIÇÃO de IONS positivos ou negativos

Como já sabemos, átomos eles são formados por partículas subatômicas. Dos três tipos de partículas subatômicas, apenas os nêutrons não têm carga elétrica. Em vez disso, os prótons têm carga elétrica positiva, enquanto os elétrons têm carga negativa. Apenas os elétrons, que ocupam a periferia do átomo, podem ser transferidos de um átomo para outro, enquanto os prótons no núcleo mantêm seu número estável. Nesta lição de um PROFESSOR, veremos o que acontece quando átomos ou moléculas ganham ou perdem elétrons. Ou seja, veremos a definição e exemplos de íons positivos ou negativos.
Índice
- O que são íons? Definição fácil
- Formação de íons: eletroafinidade e eletronegatividade
- O que são íons negativos? Com exemplos
- O que são íons positivos? Com exemplos
O que são íons? Definição fácil.
UMA íon é algum átomo ou molécula com carga elétrica líquida. Ou seja, é um átomo ou conjunto de átomos ligados entre si, cujas cargas elétricas não são compensados. Essa descompensação de cargas ocorre quando um ou mais elétrons se juntam ou saem de um átomo ou conjunto de átomos.
Os íons são assim átomos ou moléculas carregadas, devido ao ganho ou perda de elétrons (partículas subatômicas com carga negativa e massa desprezível).
Tipos de íons: monoatômico e poliatômico
Se levarmos em consideração a composição dos íons, dois tipos são distinguidos: íons monoatômicos e íons poliatômicos.
- Como o nome sugere, íons monoatômicos aqueles que são formados por um átomo único.
- Compostos iônicos o íons poliatômicos são aqueles em que os átomos estão covalentemente ligados (compartilhando um ou mais pares de elétrons na ligação) apresentando uma série de nêutrons na molécula diferente do número total de elétrons.
- O íons poliatômicos eles geralmente contêm oxigênio e geralmente têm uma estrutura com um átomo central em torno do qual os elementos restantes que constituem a molécula estão dispostos.
- O carga de íons monoatômicos dos elementos representativos (famílias 1 e 2 da tabela e famílias 13 a 17 da tabela periódica) podem ser facilmente deduzidos se sua localização na tabela periódica for conhecida. Nestes casos, os átomos ganham ou perdem elétrons para atingir, em sua camada de valência, a configuração do gás nobre de seu período (s2p6), ou o que é o mesmo, cumprir o regra do octeto.
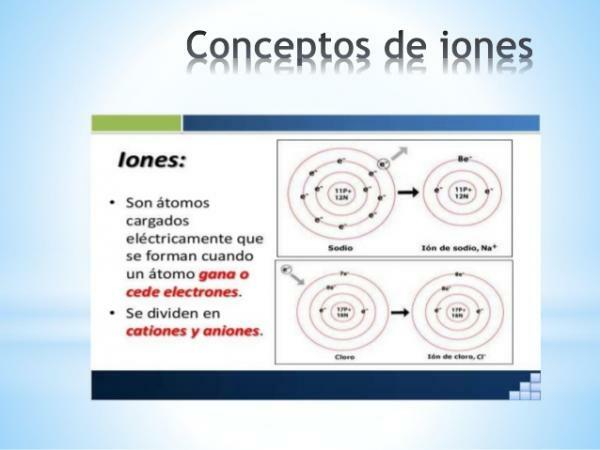
Imagem: Slideshare
Formação de íons: eletroafinidade e eletronegatividade.
A capacidade dos átomos ou moléculas de formar íons é determinado por duas propriedades periódicas: eletroafinidade e eletronegatividade. Ambas as propriedades aumentam de valor ao longo de um período e diminuem à medida que descemos através de um grupo ou família da tabela periódica.
O eletroafinidade, também chamada de afinidade eletrônica, é uma propriedade atômica definida como a capacidade de um átomo de atrair elétrons. No caso de compostos, uma propriedade semelhante chamada eletro-negatividade que é definida como a capacidade de um átomo de atrair elétrons quando forma uma ligação com outro átomo. Ambas as propriedades, portanto, definem a tendência de um elemento para capturar ou perder elétrons.
Ligações ionicas
Em sua forma sólida, os íons formam compostos ou cristais iônicos (sais), formados pela combinação de íons de diferentes signos unidos por meio de ligações ionicas. O exemplo mais conhecido deste tipo de composto é o sal comum (cloreto de sódio: NaCl).
A ligação iônica consiste em uniões de íons de sinal diferente por meio de forças de atração eletrostáticas (atração entre cargas de sinal oposto). Elementos cuja eletronegatividade ou eletroafinidade é muito diferente (elementos metálicos e não metálicos) intervêm neste tipo de elos. Na maioria dos casos, esses compostos iônicos são Solúvel em água e outros solventes polares.
Em soluções aquosas, os compostos iônicos se dissociam em íons livres, que são chamados eletrólitos, pois sua presença na solução faz com que a água se comporte como um condutor elétrico.
O que são íons negativos? Com exemplos.
O íons negativos Eles são chamados ânions. Em todos os casos, eles são átomos de elementos não metálicos ou moléculas que contêm elementos não metálicos. Esses elementos são caracterizados por possuírem eletroafinidade e eletronegatividade muito altas. Em outras palavras, eles são íons formados por elementos com uma alta tendência de capturar elétrons.
Ânions monoatômicos: definição e exemplos
São os ânions formados por átomos de elementos não metálicos (grupos 13 a 17 da tabela periódica), que ganharam um ou mais elétrons. Esses ânions têm em comum as estruturas eletrônicas de gás nobre2p6) em sua camada de elétron mais externa (camada de valência).
Exemplos:
- Íon cloreto: Cl-
- Íon fluoreto: F-
- Íon iodeto: I-
- Íon sulfeto: S-2
- Íon nitreto: N-3
Ânions poliatômicos: definição e exemplos
Eles são íons carregados negativamente formados por dois ou mais átomos de elementos não metálicos ligados por ligações covalentes. Eles são os íons poliatômicos mais comuns. Os ânions poliatômicos mais comuns são os oxoanions, que são constituídos por um átomo central não metálico e contêm oxigênio.
Em geral, eles são considerados compostos químicos obtidos quando um composto ácido perde um ou mais prótons (H+). Esses ânions poliatômicos podem reter algum hidrogênio em sua estrutura, o que lhes confere um certo caráter ácido (capacidade de liberar prótons).
Exemplos:
- Íon nitrato: NO3-
- Íon permanganato: MnO4-
- Íon fosfato: PO4-3
- Carbonato de hidrogênio ou íon bicarbonato: HCO3-
- Íon sulfito: SO3-2
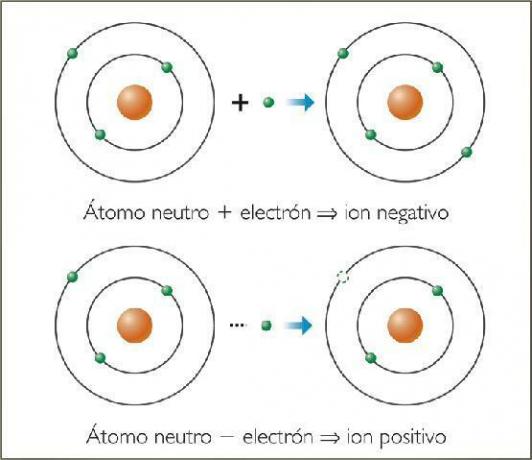
Imagem: Naturopatia
O que são íons positivos? Com exemplos.
Os íons positivos são chamados cações. Em quase todos os casos, eles são átomos de elementos metálicos ou moléculas que contêm elementos metálicos. Esses elementos são caracterizados por apresentarem eletroafinidade e eletronegatividade muito baixas, razão pela qual apresentam uma clara tendência à perda de elétrons.
Cátions monoatômicos: definição e exemplos
São íons com carga positiva (devido à perda de elétrons) formados por um único átomo de um elemento metálico. Neste caso, o cátion é formado pela perda de elétrons que permite ao elemento esvaziar sua camada eletrônica mais externa e adquirir uma configuração de gás nobre (s2p6) do nível inferior. Eles são o tipo mais comum de cátion.
Exemplos:
- Hidrogênio ou cátion hydron (também chamado de próton): H+
- Catião de sódio: Na+
- Catião ferro (III) ou catião férrico: Fe+3
- Catião cálcio: Ca+2
- Cobre (II) ou catião cúprico: Cu+2
Cátions poliatômicos: definição e exemplos
Os cátions poliatômicos são aqueles formados por dois ou mais átomos. Eles são raros, os mais abundantes são os chamados cátions homopoliatômicos que são aqueles que contêm mais de um átomo do mesmo elemento, no caso do íon trihidrogênio, é uma das moléculas mais abundantes do universo. Os cátions poliatômicos formados por átomos de diferentes elementos não são comuns, mas são caracterizados por a presença de hidrogênio e é considerada originada quando um composto básico captura um próton (H+).
Exemplos:
- Catião amônio: NH4+
- Catião oxônio: HO3+
- Catião fosfônio: PH3+
- Catião trihidrogênio ou hidrogênio molecular protonado: H3+
- Catião dimercúrio: Hg2+2
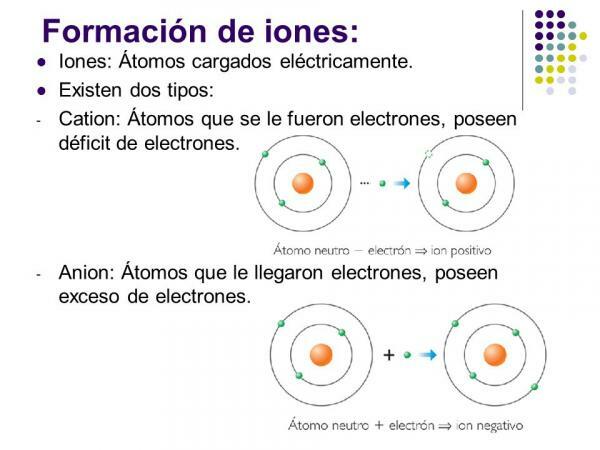
Imagem: Planetas
Se você quiser ler mais artigos semelhantes a Íons negativos e positivos: definição e exemplos, recomendamos que você insira nossa categoria de O átomo.
Bibliografia
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Química básica. Madrid: Uned

