Partes de um átomo e suas características
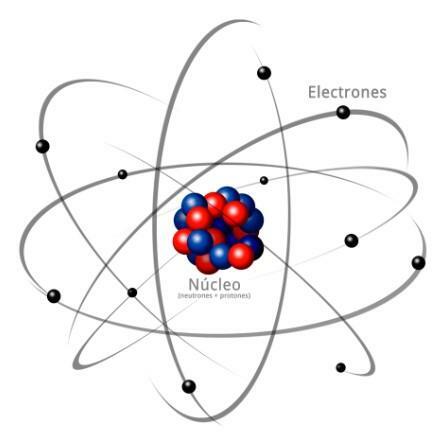
Imagem: Answers.tips
Os átomos são os elementos básicos que matéria de forma, estando presente em todos os estados da matéria. São elementos muito pequenos, impossíveis de ver através do olho humano, mas são realmente importantes para o nosso universo. Para entender melhor como são os átomos e como funcionam, nesta lição de um PROFESSOR, vamos falar sobre partes de um átomo e suas características.
Todos os átomos são constituídos por um núcleo e uma crosta. O núcleo, como o próprio nome indica, é a parte central do átomo, onde estão as partículas cuja carga é positiva e que são chamadas prótons, e as partículas cuja carga é neutra, ou seja, não possuem carga elétrica, recebendo o nome de nêutrons. A massa de ambas as partículas, prótons e nêutrons, são semelhantes. Todos os átomos de um mesmo elemento químico possuem igual número de prótons, recebendo a esse número o nome de número atômico e utilizando a letra Z para representá-lo.
Por outro lado, existe o Córtex que é a parte externa do átomo
. Na casca encontramos o elétrons, que são partículas carregadas negativamente. Os elétrons giram em grande velocidade ao redor do núcleo em diferentes níveis, sendo partículas muito menores do que aquelas que estão localizadas no núcleo.Sendo nêutrons neutros, prótons positivos e elétrons negativos, o átomo tem uma carga elétrica neutra, uma vez que eles têm o mesmo número de prótons que elétrons. Embora existam casos em que os elétrons estão em menor ou maior número do que os prótons, causando a carga o átomo é negativo ou positivo, neste caso recebe o nome de íon, ânion se for negativo ou cátion se for positivo.
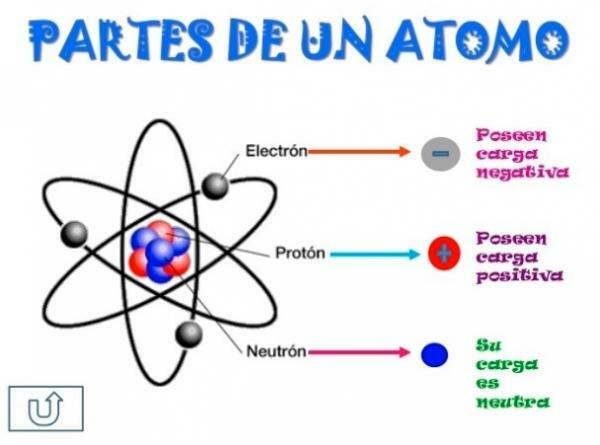
Imagem: Brainly
Para continuar com esta lição sobre as partes de um átomo e suas características, devemos falar sobre a evolução que as partes do átomo tiveram, desde o modelo atômico mudou ao longo do tempo graças aos estudos de cientistas. Deve-se levar em consideração que vários dos modelos que vamos explicar estão obsoletos, não sendo utilizados atualmente, mas são necessários para entender a evolução da comunidade científica sobre o assunto.
A evolução histórica do modelo atômico é caracterizada por seguindo cientistas:
- Modelo Dalton: O primeiro modelo atômico foi obra de John Dalton em 1803. É um modelo muito primitivo que carece de muitos elementos, como a presença de elétrons e prótons.
- Modelo Thomson: John Thomson conseguiu fazer um modelo atômico mais completo do que o de Dalton, adicionando vários elementos-chave. Thomson descobriu a existência de elétrons e cargas positivas e negativas.
- Modelo Nagaoka: O físico japonês Nagaoka discordou do modelo de Thomson, ele pensava que o átomo deve ter um grande núcleo carregado positivamente no qual os elétrons carregados negativamente giram. Sua teoria é chamada de Saturno, pois ele comparou os elétrons aos anéis de Saturno. Muitas vezes esse modelo não tem nome, mas é fundamental entender o grande passo que se dá neste momento.
- Modelo Rutherford: O modelo de Rutherford se baseava na existência de um núcleo carregado positivamente no qual os elétrons carregados negativamente giravam. Este modelo é muito semelhante ao de Nagaoka, sendo de anos muito próximos, embora o modelo japonês seja anterior.
- Modelo Bohr: Bohr achava que os elétrons deveriam ser separados a uma grande distância do núcleo em camadas e o número dessas partículas orbitais deveria ser igual ao número atômico. Seu modelo também entende que o número de elétrons varia em cada camada, com menos elétrons na primeira camada do que na última.
- Modelo Schrodinger: Schrõdinger quebrou a crença de que os elétrons são partículas minúsculas que giram em torno do núcleo. O cientista austríaco argumentou que os elétrons se movem por meio de uma função de onda, ou seja, por forma orbital.
- Modelo Dirac: Dirac modificou as idéias de Schrõdinger para seu modelo, usando a "equação de Dirac" para dar uma visão mais correta da forma orbital dos elétrons.
