Os 10 tipos de ligações químicas (explicados com exemplos)
Ligações químicas são o forças que mantêm os átomos unidos para formar as moléculas. Existem três tipos de ligações entre os átomos:
- Ligação metálica.
- Ligação iônica.
- Ligação covalente: apolar, polar, simples, dupla, tripla, dativa.
Graças a essas ligações, todos os compostos existentes na natureza são formados. Existem também forças que mantêm as moléculas juntas, conhecidas como ligações intermoleculares, tais como:
- Ligações ou ligações de hidrogênio.
- Forças dipolo-dipolo.
A seguir, explicamos cada um desses links.
| Tipos de ligação química | Característica | Exemplos | |
|---|---|---|---|
| Metal | Os íons metálicos flutuam em um mar de elétrons em movimento. | Elementos metálicos: sódio, bário, prata, ferro, cobre. | |
| Iônico | Transferência de elétrons de um átomo para outro. | Na cloreto de sódio+Cl- | |
| Covalente | Não polar | Compartilhe elétrons igualmente entre dois átomos. | Hidrogênio molecular H-H ou H2 |
| Polar | Compartilhe elétrons de maneira desigual entre dois átomos. | Molécula de água H2OU | |
| Simples | Compartilhe um par de elétrons. | Molécula de cloro Cl2 Cl-Cl | |
| Dobro | Compartilhe dois pares de elétrons. | Molécula de oxigênio O2 O = O | |
| Triplo | Compartilhe três pares de elétrons. | Molécula de nitrogênio N≣N ou N2 | |
| Dativo | Apenas um dos átomos compartilha os elétrons. | Ligação entre nitrogênio e boro no trifluoreto de amônia-boro composto. | |
| Forças intermoleculares | Ponte de hidrogênio | Os hidrogênios em uma molécula são atraídos pelos átomos eletronegativos de outra molécula. | O hidrogênio se liga entre o hidrogênio de uma molécula de água e o oxigênio de outra molécula de água. |
| Dipolo-dipolo | Moléculas com dois pólos elétricos atraem os pólos opostos de outras moléculas. | Interações entre moléculas H metanais2C = O |
Ligação metálica
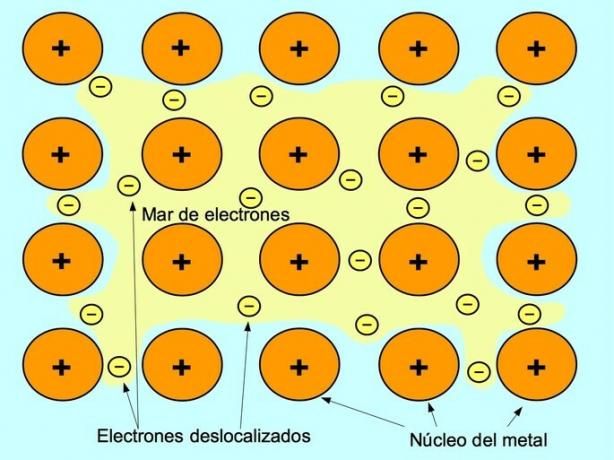
A ligação metálica é a força de atração entre os íons positivos dos elementos metálicos e os elétrons negativos que se movem livremente entre os íons. Os átomos de metal são compactados, o que permite que os elétrons se movam dentro da estrutura dos átomos.
Nos metais, os elétrons de valência são liberados de seu átomo original e formam um "mar" de elétrons que flutua ao redor de toda a estrutura metálica. Isso faz com que os átomos de metal se transformem em íons de metal com carga positiva que se compactam.
A ligação metálica é estabelecida entre elementos metálicos como sódio Na, bário Ba, cálcio Ca, magnésio Mg, ouro Au, prata Ag e alumínio Al.
Ligação iônica
A ligação iônica é a força que une um elemento metálico, como sódio ou magnésio, a um elemento não metálico, como cloro ou enxofre. O metal perde elétrons e se transforma em um íon metálico positivo chamado cátion. Esses elétrons passam para o elemento não metálico e ele se transforma em um íon carregado negativamente chamado ânion.
Os cátions e ânions se combinam e formam uma rede tridimensional que é mantida pelas forças de atração eletrostática entre os íons com cargas diferentes. Essas forças formam compostos iônicos.
A crosta terrestre é composta principalmente de compostos iônicos. A maioria das rochas, minerais e pedras preciosas são compostos iônicos. Por exemplo:
- Cloreto de Sódio NaCl: o elemento metálico é o sódio que transfere um elétron para o cloro, que é o elemento não metálico.
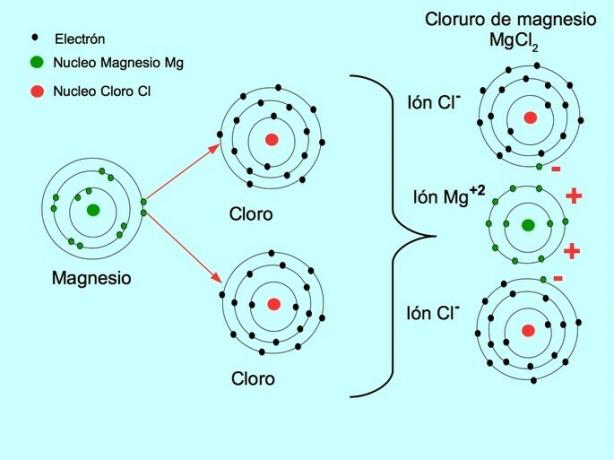
- Cloreto de Magnésio MgCl2: Magnésio Mg doa dois elétrons para dois átomos de cloro, conforme mostrado na figura abaixo:
Veja também Diferença entre cátions e ânions.
Ligação covalente
A ligação covalente se forma quando dois átomos não metálicos compartilham elétrons. Essa ligação pode ser de vários tipos, dependendo da afinidade pelos elétrons dos átomos e da quantidade de elétrons compartilhados.
Ligação covalente não polar
A ligação covalente apolar é a ligação que se forma entre dois átomos onde os elétrons são compartilhados igualmente. Essa ligação normalmente ocorre em moléculas simétricas, ou seja, moléculas compostas por dois átomos iguais, como a molécula de hidrogênio H2 e a molécula de oxigênio O2.

Ligação covalente polar
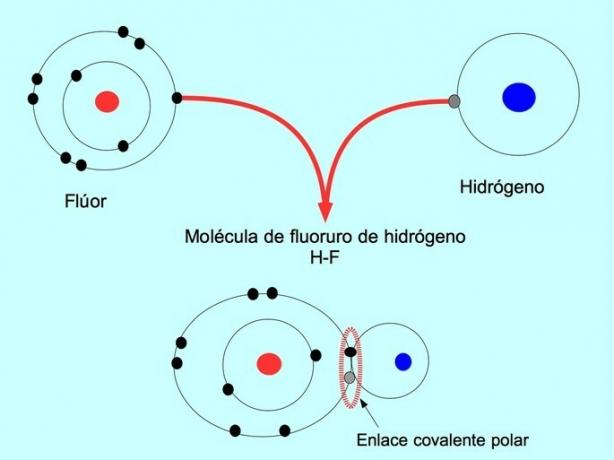
A ligação covalente polar é formada quando dois átomos compartilham elétrons, mas um deles tem maior atração por elétrons. Isso faz com que a molécula tenha um "pólo" mais negativo com mais elétrons e o pólo oposto seja mais positivo.
Moléculas com esta distribuição ou desequilíbrio de elétrons são conhecidas como polares. Por exemplo, no fluoreto de hidrogênio HF, há uma ligação covalente entre o hidrogênio e o flúor, mas o flúor tem maior eletronegatividade, por isso atrai elétrons com mais força compartilhado.
Ligação covalente simples
Quando dois átomos compartilham dois elétrons, um de cada, a ligação covalente formada é chamada de ligação covalente única.
Por exemplo, o cloro é um átomo que possui sete elétrons de valência em sua camada externa, que pode ser preenchida com oito elétrons. Um cloro pode se combinar com outro cloro para formar a molécula de cloro Cl2 que é muito mais estável do que o cloro sozinho.
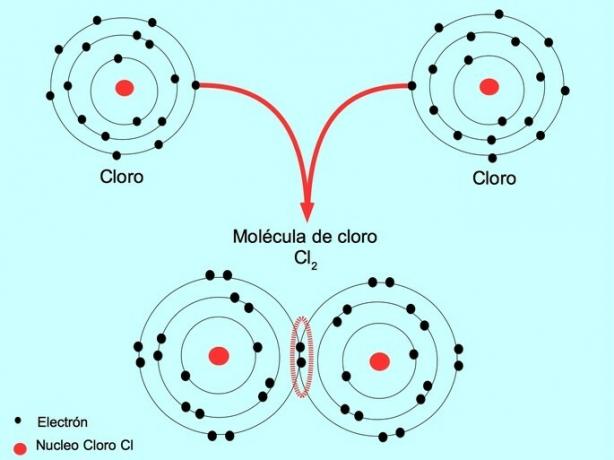
Ligação covalente dupla
A ligação covalente dupla é a ligação onde quatro elétrons (dois pares) de elétrons são compartilhados entre dois átomos. Por exemplo, o oxigênio tem 6 elétrons em sua última camada. Quando dois oxigênios são combinados, quatro elétrons são compartilhados entre os dois, fazendo com que cada um tenha 8 elétrons na última camada.
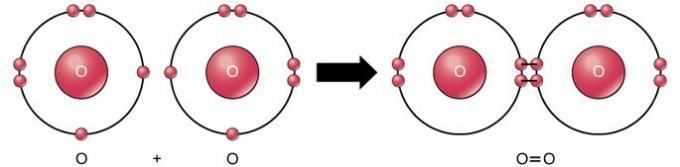
Ligação covalente tripla
A ligação covalente tripla é formada quando 6 elétrons (ou três pares) são compartilhados entre dois átomos. Por exemplo, na molécula de cianeto de hidrogênio HCN, uma ligação tripla é formada entre o carbono e o nitrogênio, conforme apresentado na figura abaixo:
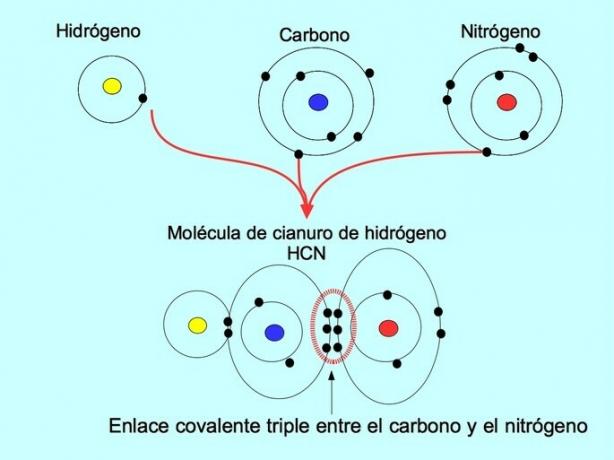
Ligação covalente coordenada ou dativa
A ligação covalente coordenada ou dativa é a ligação que se forma quando apenas um dos átomos na ligação contribui com um par de elétrons. Por exemplo, quando a amônia NH reage3 com trifluoreto de boro BF3, O nitrogênio se liga com dois elétrons diretamente ao boro, que não tem elétrons disponíveis para compartilhar. Dessa forma, tanto o nitrogênio quanto o boro ficam com 8 elétrons em sua camada de valência.
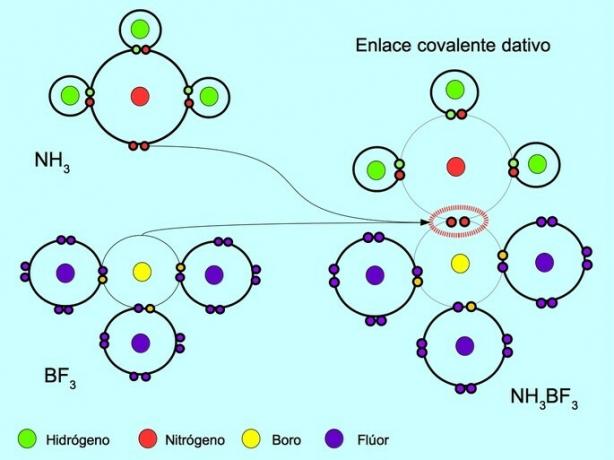
Veja também Compostos orgânicos e inorgânicos.
Links intermoleculares
As moléculas se associam por meio de forças que permitem formar substâncias em estado líquido ou sólido.
Ligações ou forças dipolo-dipolo
Ligações intermoleculares fracas podem ser estabelecidas entre as moléculas polares quando os pólos negativos são atraídos para os pólos positivos e vice-versa. Por exemplo, metanal H2C = O é uma molécula polar, com uma carga parcial negativa no oxigênio e uma carga parcial positiva nos hidrogênios. O lado positivo de uma molécula de metanal atrai o lado negativo de outra molécula de metanal.
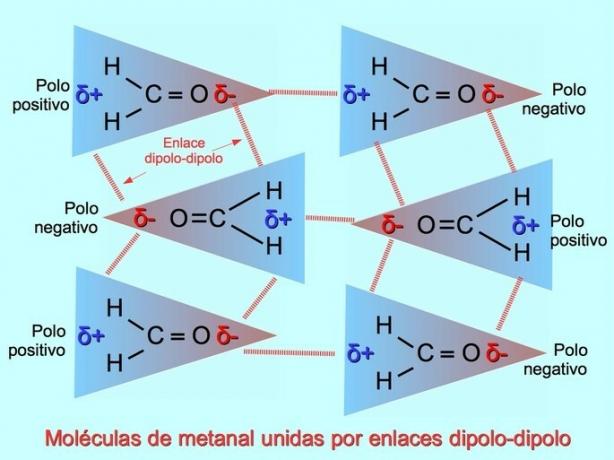
Ligações ou ligações de hidrogênio
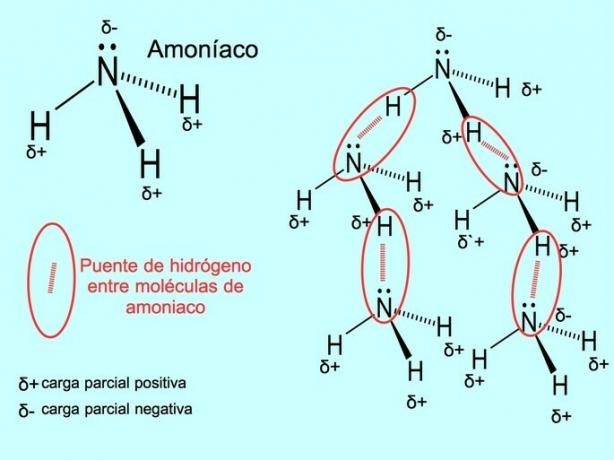
A ligação de hidrogênio ou ligação de hidrogênio é uma ligação que é estabelecida entre as moléculas. Ocorre quando um hidrogênio na molécula está covalentemente ligado a um oxigênio, nitrogênio ou flúor. Oxigênio, nitrogênio e flúor são átomos com maior eletronegatividade, portanto atraem elétrons mais fortemente quando os compartilham com outro átomo menos eletronegativo.
Existem ligações de hidrogênio entre as moléculas de água H2O e amônia NH3 como mostra a imagem:
Você pode estar interessado em ver:
- Átomos e moléculas.
- Exemplos de compostos orgânicos e inorgânicos.
- Metais e não metais
Referências
Zumdahl, S.S., Zumdahl, S.A. (2014) Chemistry. Nona edição. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5ª edição. Pearson Australia. Melbourne.