Diferença entre reações endotérmicas e reações exotérmicas
UMA reação endotérmica requer energia enquanto um reação exotérmica libera energia. Esta classificação de reações químicas leva em consideração a participação da energia como um reagente ou como um produto.
Energia é a capacidade de trabalhar ou produzir calor. Lembre-se de que as reações químicas envolvem uma reorganização de átomos entre substâncias com quebra ou formação de ligações químicas. Em geral, essa formação ou quebra de ligações químicas é acompanhada por mudanças na energia do sistema.
| Reação endotérmica | Reação exotérmica | |
|---|---|---|
| Definição | Reação química onde a energia é absorvida. | Reação química onde a energia é liberada na forma de calor. |
| Origem da energia | Do ambiente | Do sistema |
| Energia potencial | Menor em reagentes do que em produtos. | Mais alto em reagentes do que em produtos. |
| Produção | Não espontâneo | Espontâneo |
| Mudança de energia interna | ΔE> 0; mudança de energia interna maior que zero. | ΔE <0; mudança de energia interna menor que zero. |
| Temperatura | Diminui | Aumentos |
| Exemplos | Reações em fotossíntese e síntese em geral. | Um fósforo aceso, reações de combustão. |
O que é uma reação endotérmica?
Uma reação química é endotérmica quando absorve energia do meio ambiente. Nesse caso, o calor é transferido de fora para dentro do sistema. Quando colocamos um termômetro durante a reação endotérmica, a temperatura cai.
A palavra "endotérmico" deriva do grego Fim que significa "dentro" e therme que significa "calor". As reações endotérmicas não ocorrem espontaneamente.
De onde vem a energia nas reações endotérmicas?
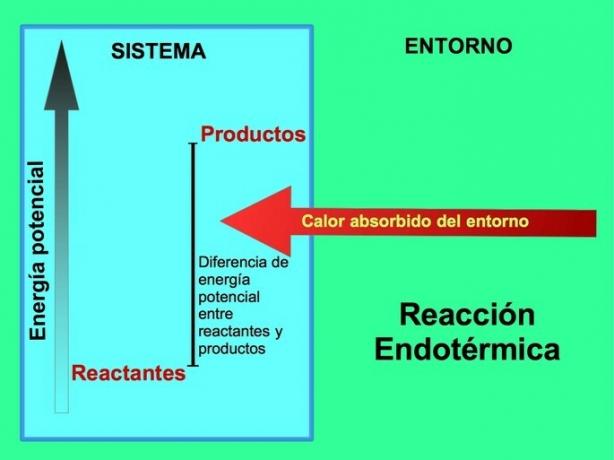
Nas reações endotérmicas, a energia vem do ambiente externo ao sistema. A quantidade de energia potencial dos produtos é maior do que a energia potencial dos reagentes. Portanto, é necessário adicionar energia aos reagentes para que a reação prossiga. Essa energia vem do calor do meio ambiente.
Por exemplo, fotossíntese é um processo endotérmico, onde as plantas capturam energia solar para produzir glicose a partir de dióxido de carbono e oxigênio:

Os produtos da reação de fotossíntese, glicose e oxigênio, possuem uma maior quantidade de energia potencial com relação aos reagentes, dióxido de carbono e água. Outros exemplos de reações químicas endotérmicas com a quantidade de energia usada:

Exemplos de reação endotérmica
Não é apenas no laboratório de química que ocorrem as reações. No dia a dia, também encontramos situações onde ocorrem reações endotérmicas.
Cozinhando comida
Embora possa não parecer, o processo de cozimento dos alimentos é endotérmico. Para consumir certos alimentos, devemos fornecer calor.
Bolsa fria instantânea
As compressas frias usadas para tratar inchaços ou entorses são preenchidas com água, mas quando sacudidas ou batidas, uma cápsula contendo nitrato de amônio quebra dentro. Misturar nitrato de amônio com água é uma reação endotérmica, fazendo com que o saco esfrie.
Você pode estar interessado em ver o Diferença entre calor e temperatura.
O que é uma reação exotérmica?
UMA reação exotérmica é aquela em que a energia flui para fora do sistema. Essa energia é liberada na forma de calor, portanto, a colocação de um termômetro no sistema de reação aumenta a temperatura.
A palavra "exotérmica" é formada por exo que significa "para fora" e thermes, que significa "calor". As reações exotérmicas podem ocorrer espontaneamente e, em alguns casos, ser explosivas, como a combinação de metais alcalinos e água.
De onde vem a energia nas reações exotérmicas?
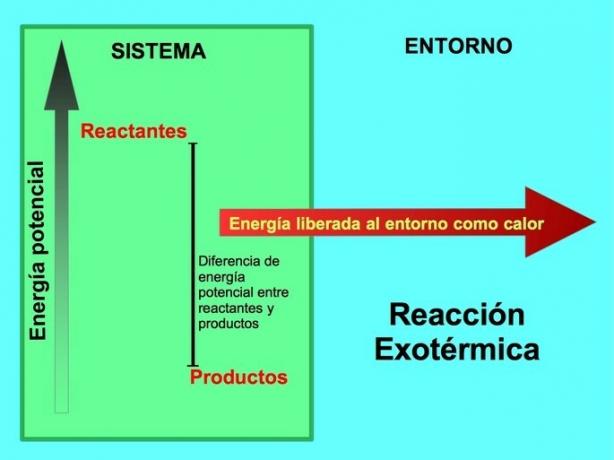
Em uma reação química, os reagentes são os compostos que transformam e dão origem aos produtos. Por exemplo, quando o sódio Na reage com cloro Cl, estes são os reagentes e o produto é cloreto de sódio NaCl:

Tanto os reagentes quanto os produtos armazenaram energia potencial. Nós sabemos do lconservação de energia ey essa energia não é perdida nem ganha, então a energia dos reagentes deve ser igual à dos produtos.
Em uma reação exotérmica, los reagentes têm mais energia potencial em comparação com os produtos, então o excesso de energia é liberado como calor. Nesse caso, a energia também é considerada como parte dos produtos:

Em qualquer processo exotérmico, parte da energia potencial armazenada nas ligações químicas é convertida em energia térmica por meio do calor.
Exemplos de reação exotérmica
Detergente para roupa
Quando dissolvemos um pouco de sabão em pó com água nas mãos, podemos sentir um leve aquecimento.
Combustão de gás doméstico
A combustão de gases de uso doméstico, como metano ou butano, envolve a reação química com o oxigênio com a formação de dióxido de carbono e água, além da liberação de energia. Esta é uma reação exotérmica típica no uso diário:
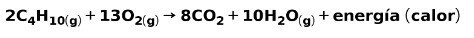
A energia liberada no processo de combustão é usada para cozinhar alimentos.
Você também pode estar interessado em saber o que são Sistema aberto, sistema fechado e sistema isolado.



