Diferença entre ácidos e bases fortes e fracos (com exemplos)
Uma classificação de ácidos e bases em química depende da força de ionização dessas substâncias em meio aquoso. A) Sim:
- uma ácido e uma base são fortes quando estão completamente ionizados, ou seja, no processo de ionização são completamente transformados em cátions ou íons positivos e em ânions ou íons negativos.
- Por outro lado, um ácido e uma base são fracos quando estão parcialmente ionizados em água, ou seja, em solução haverá uma proporção de cátions, outra proporção de ânions e outra proporção de moléculas indissociadas.
| Ácidos e bases fortes | Ácidos e bases fracos | |
|---|---|---|
| Definição | Substâncias que ionizam completamente em solução. | Substâncias que ionizam parcialmente em solução. |
| Ionizacao | Completo | Parcial |
| Elementos em solução aquosa | Cátions e ânions na mesma concentração. | Cátions, ânions e moléculas em diferentes proporções. |
| Constante de ionização | Elevado | Pouco |
| Exemplos |
|
|
Ácidos e bases fortes
UMA ácido ou uma base são fortes quando em um meio aquoso eles se dissociam completamenteEm outras palavras, o processo de ionização está completo e a solução conterá a mesma concentração de ânions e cátions.
Como você ioniza um ácido e uma base forte?
Um ácido forte, como o ácido clorídrico HCl, ioniza-se das seguintes maneiras:
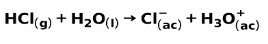
Uma base forte, como hidróxido de sódio NaOH, ioniza-se das seguintes maneiras:
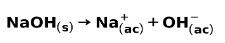
Exemplos de ácidos fortes e suas fórmulas
| Ácidos fortes | Fórmula |
|---|---|
| Ácido clorídrico | HCl |
| Ácido sulfúrico | H2SW4 |
| Ácido nítrico | HNO3 |
| Ácido bromídrico | HBr |
| Ácido perclórico | HClO4 |
| Ácido crômico | H2CrO4 |
| Ácido tetraflurobórico | HBF4 |
Exemplos de bases fortes e suas fórmulas
| Base forte | Fórmula |
|---|---|
| De hidróxido de sódio | NaOH |
| Hidróxido de lítio | LiOH |
| Hidróxido de potássio | KOH |
| Hidróxido de rubídio | RbOH |
| Hidróxido de césio | CsOH |
| Hidróxido de cálcio | Ca (OH)2 |
| Hidróxido de bário | Ba (OH)2 |
| Hidróxido de estrôncio | Sr (OH)2 |
| Hidróxido de alumínio | Al (OH)3 |
Você pode estar interessado em ver mais exemplos de ácidos e bases.
Ácidos e bases fracos
UMA O ácido ou base é fraco quando parcialmente ionizado em solução aquosa, ou seja, na solução existem íons e moléculas não ionizadas.
Como você ioniza um ácido e uma base fraca?
Um ácido fraco, como o ácido acético CH3COOH, é ionizado da seguinte maneira:
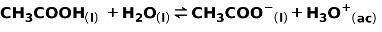
O equilíbrio desta reação é expresso pelas duas setas em direções opostas.
Quando um ácido fraco se dissocia ou ioniza, um equilíbrio é estabelecido entre as espécies presentes na solução; isso pode ser expresso por um constante de ionizaçãoazedo:
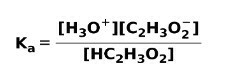
A constante de ionização nada mais é do que a razão entre a multiplicação da concentração dos produtos pela multiplicação da concentração dos reagentes.
Uma base fraca, como NH amônia3, é ionizado da seguinte maneira:
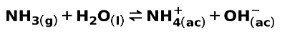
Quando uma base fraca se dissocia ou ioniza, um equilíbrio é estabelecido entre as espécies presentes na solução; isso pode ser expresso por um constante de ionização de base:
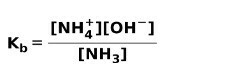
Você pode estar interessado em saber a diferença entre Ácidos e bases.
Exemplos de ácidos fracos com sua fórmula e constante de ionização de ácido Kpara
| Ácido fraco | Fórmula | Constante de ionização |
|---|---|---|
| Ácido fórmico | H2CO2 | 1,77 x 10-4 |
| Ácido acético | H3CCOH | 1,75 x 10-5 |
| Ácido cianídrico | HOCN | 3,30 x 10-4 |
| Cianeto de hidrogenio | HCN | 6,20 x 10-10 |
| Ácido Hipocloroso | HOCl | 3,50 x 10-8 |
| Ácido nitroso | HNO2 | 4,00 x 10-4 |
| Ácido láctico | HC3H5OU3 | 1,40 x 10-4 |
| Ácido carbónico | H2CO3 |
4,30 x 10-7 5,60 x 10-11 |
| Ácido bórico | H3BO3 |
5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Exemplos de bases fracas com sua fórmula e constante de ionização básica Kb
| Base fraca | Fórmula | Constante de ionização |
|---|---|---|
| Amônia | NH3 | 1,75 x 10-5 |
| Metilamina | CH3NH2 | 4,38 x 10-4 |
| Etilamina | C2H5NH2 | 5,60 x 10-4 |
| Anilina | C6H5NH2 | 3,80 x 10-10 |
| Piridina | C5H5N | 1,70 x 10-9 |
| Benzilamina | C7H9N | 2,20 x 10-5 |
| Bicarbonato de Sódio | NaHCO | 2,00 x 10-4 |
Você pode estar interessado em saber mais sobre Características de ácidos e bases



