Características de ácidos e bases: principais diferenças
As características dos ácidos e bases são todas as propriedades e qualidades com as quais podemos distinguir entre um ácido e uma base.
De acordo com a teoria de Arrehnius, um ácido é uma substância que libera prótons H+ quando dissolvido em água, e um base é qualquer substância que libera íons hidroxila OH- quando em solução aquosa.
| Ácidos | Bases | |
|---|---|---|
| Formação de íons | Presente | Presente |
| Reação neutralizadora | Quando reage com uma base. | Quando reage com um ácido. |
| Solubilidade em água | Solúvel | Parcialmente solúvel. Os hidróxidos de cálcio, bário e alumínio são pouco solúveis. |
| Condutividade elétrica | Presente | Presente |
| Estado da matéria | Sólido, líquido ou gasoso | Sólido, líquido ou gasoso |
| Reação com papel de tornassol | Coloração vermelha | Coloração azul |
| valor do PH | Menos de 7 | Maior que 7 |
| Contraparte conjugada | Um ácido fraco forma uma base conjugada. | Uma base fraca forma um ácido conjugado. |
| Efeito corrosivo | Ácidos fortes | Bases fortes |
Características dos ácidos
Os ácidos têm várias características com as quais podem ser identificados.
Capacidade de formar íons a partir de ácidos
A principal característica das substâncias ácidas é que podem ser ionizadas, ou seja, perdem ou ganham elétrons.
O ácido clorídrico HCl, um ácido forte, ioniza-se para formar o ânion cloreto Cl- e próton H+.
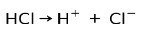
Reação neutralizadora
Um ácido reage com uma base para formar um sal e água. Esta reação é conhecida como reação neutralizadora. Por exemplo, HCl reage com NaOH para formar cloreto de sódio NaCl (sal de cozinha) e água:
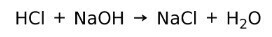
Hidrossolubilidade de ácidos
Os ácidos são geralmente solúveis em água. Por exemplo, o ácido clorídrico ou ácido muriático é moderadamente solúvel em água, até 82 g de HCl podem ser dissolvidos em 100 ml de água a 0ºC. No caso do ácido sulfúrico H2SW4, a mistura com a água gera calor, por isso é sempre aconselhável adicionar o ácido à água para evitar explosões.
Força ácida
Como os ácidos se dissociam determina se eles são fortes ou fracos. A força de um ácido é dada por sua constante de dissociação.
Ácido nítrico HNO3 é um ácido forte porque em solução aquosa ele se ioniza completamente em prótons e íons nitrato:

Isso significa que quando adicionamos HNO3 na água, ao analisar a água, encontraremos apenas H+ e íons de nitrato, e virtualmente nenhum HNO3.
Em vez disso, o ácido acético encontrado no vinagre é um ácido fraco, porque apenas parte dela está dissociada:
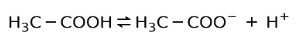
Por isso é representado com setas em duas direções, isso significa que em solução aquosa teremos ácido acético, H+ e o ânion acetato (H3C-COO-).
Estados da matéria dos ácidos
Os ácidos podem ser encontrados no estado líquido, sólido ou gasoso. Por exemplo, o ácido clorídrico HCl é líquido, o sulfeto de hidrogênio HS é um gás e o ácido oxálico é um sólido.
Reação com papel de tornassol de ácidos

Quando colocamos uma tira de papel de tornassol em uma substância ácida, o papel de tornassol fica vermelho.
Identificação de ácidos por seu pH
PH é a medida da quantidade de H+ presente em uma solução. Assim, entre pH 0 e 7, estamos na presença de um ácido. Por exemplo, o vinagre tem um pH igual a 2, o pH do ácido sulfúrico em baterias de automóveis é igual a 1.
Condutividade elétrica de ácidos
Uma vez que os ácidos podem se dissociar e produzir íons carregados eletricamente, as soluções ácidas podem conduzir eletricidade. Por exemplo, dentro de baterias de automóveis, o ácido sulfúrico, que é um ácido forte, é usado como condutor de eletricidade.
Efeito corrosivo de ácidos fortes
Ácidos fortes têm efeito corrosivo, podem queimar tecidos orgânicos, portanto, seu manuseio deve ser extremamente cuidadoso.
Ácidos fracos formam uma contraparte conjugada
Ácidos fracos quando dissolvidos formam o que é conhecido como um par conjugado, ou seja, um ácido fraco forma uma base conjugada.
Por exemplo:

Nesse caso, o ácido fórmico ou metanóico (HCOOH), quando dissociado, forma o formato de íon base conjugado.
Pode interessar a você:
- Ácidos e bases fortes e fracos.
- Exemplos de ácidos e bases.
Características das bases
A seguir apresentamos as propriedades das bases ou soluções alcalinas que as caracterizam.
Capacidade de ionização de base
As substâncias básicas ou alcalinas são caracterizadas por formar íons quando dissolvidas em água:

Neste caso, o hidróxido de sódio NaOH ioniza para formar um ânion hidróxido OH- e um cátion sódio Na+.
Uma base reage com um ácido para formar um sal
Uma base reage com um ácido em uma reação de neutralização para formar água e um sal, por exemplo:

Neste caso, o hidróxido de alumínio Al (OH)3, uma base, reage com HCl e forma o sal de cloreto de alumínio AlCl3 e água. O hidróxido de alumínio é usado como antiácido para aliviar o refluxo gástrico, neutralizando o ácido produzido pelo estômago.
Bases de solubilidade em água
Algumas bases são solúveis em água. Os hidróxidos alcalino-terrosos, como o hidróxido de cálcio e o hidróxido de bário, são pouco solúveis em água. Por exemplo, hidróxido de sódio ou soda cáustica podem ser dissolvidos 109 g em 100 ml de água a 20ºC. Enquanto hidróxido de magnésio ou leite de magnésia Mg (OH)2 é praticamente insolúvel em água.
Força de base
Dependendo do grau de ionização da base, estes podem ser fortes ou fracos. Por exemplo, o hidróxido de lítio é um base forte porque em solução aquosa ele se ioniza completamente em íons de hidróxido OH e cátions de lítio Li+:
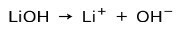
Por outro lado, amônia NH3 é uma base fraca porque quando entra em contato com a água, nem toda a amônia se dissocia:
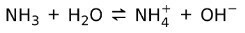
Estado das bases
As bases podem ser encontradas nos estados sólido, líquido e gasoso. Por exemplo, o hidróxido de sódio puro é sólido, a amônia é um gás.
Reação com o papel de tornassol das bases
Quando colocamos uma tira de papel de tornassol em uma substância alcalina, o papel fica azul.
Identificação de bases por seu pH
As bases são caracterizadas por possuírem um pH entre 7 e 14.
 Condutividade elétrica das bases
Condutividade elétrica das bases
As bases devido à sua capacidade de ionização são bons condutores de eletricidade. Por exemplo, em baterias alcalinas, o hidróxido de potássio KOH é usado como condutor elétrico.
Efeito corrosivo de bases
As bases fortes podem danificar os tecidos orgânicos. Por exemplo, os limpadores de forno de cozinha são geralmente bases fortes e é sempre recomendável manuseá-los com muito cuidado, usando luvas e proteção para os olhos.
As bases fracas formam uma contraparte conjugada
As bases fracas, quando dissolvidas, formam uma contraparte conjugada, ou seja, uma base fraca forma um ácido conjugado.
Por exemplo, tris- (hidroximetil) amino metano (OHCH2)3CNH2 é uma base fraca cujo ácido conjugado é (OHCH2)3CNH3+:
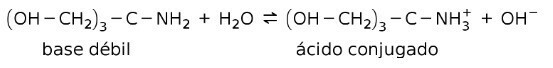
Esta é a base de ação das substâncias tampão ou amortecedor, que são substâncias utilizadas para manter o pH das soluções constantemente.
Você pode estar interessado em saber as diferenças entre:
- Ácidos e bases.
- Cátions e ânions