Cele 10 tipuri de legături chimice (explicate cu exemple)
Legăturile chimice sunt forțe care țin atomi împreună pentru a forma moleculele. Există trei tipuri de legături între atomi:
- Legătură metalică.
- Legătură ionică.
- Legătura covalentă: nepolară, polară, simplă, dublă, triplă, dativă.
Datorită acestor legături, se formează toți compușii care există în natură. Există, de asemenea, forțe care țin molecule împreună, cunoscute sub numele de legături intermoleculare, cum ar fi:
- Legături de hidrogen sau punți.
- Forțele dipol-dipol.
În continuare, vă explicăm fiecare dintre aceste linkuri.
| Tipuri de legături chimice | Caracteristică | Exemple | |
|---|---|---|---|
| Metal | Ionii metalici plutesc într-o mare de electroni în mișcare. | Elemente metalice: sodiu, bariu, argint, fier, cupru. | |
| ionic | Transferul de electroni de la un atom la altul. | Clorură de sodiu de Na+Cl- | |
| Covalent | Non-polar | Împărțiți electroni în mod egal între doi atomi. | Hidrogen molecular H-H sau H2 |
| Polar | Împarte electronii inegal între doi atomi. | Molecula de apă H2SAU | |
| Simplu | Împărtășește o pereche de electroni. | Molecula de clor Cl2 Cl-Cl | |
| Dubla | Împărțiți două perechi de electroni. | Molecula de oxigen O2 O = O | |
| Triplu | Împărtășiți trei perechi de electroni. | Molecula de azot N≣N sau N2 | |
| Dativ | Doar unul dintre atomi împarte electronii. | Legătură între azot și bor în compusul trifluorură de amoniac-bor. | |
| Forte intermoleculare | Podul cu hidrogen | Hidrogenii dintr-o moleculă sunt atrași de atomii electronegativi ai altei molecule. | Legături de hidrogen între hidrogenul unei molecule de apă și oxigenul din altă moleculă de apă. |
| Dipol-dipol | Moleculele cu doi poli electrici atrag polii opuși ai altor molecule. | Interacțiuni între moleculele H metanale2C = O |
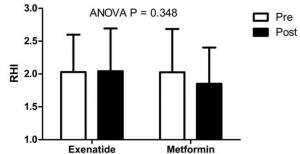
Legătură metalică
Legătura metalică este forța de atracție dintre ionii pozitivi ai elementelor metalice și electronii negativi care se mișcă liber între ioni. Atomii metalici sunt strâns împachetați, ceea ce permite electronilor să se deplaseze în rețeaua atomilor.
În metale, electronii de valență sunt eliberați din atomul lor original și formează o „mare” de electroni care plutesc în jurul întregii structuri metalice. Acest lucru face ca atomii metalici să se transforme în ioni metalici încărcați pozitiv care se împachetează împreună.
Legătura metalică se stabilește între elementele metalice, cum ar fi sodiu Na, bariu Ba, calciu Ca, magneziu Mg, aur Au, argint Ag și aluminiu Al.
Legătură ionică
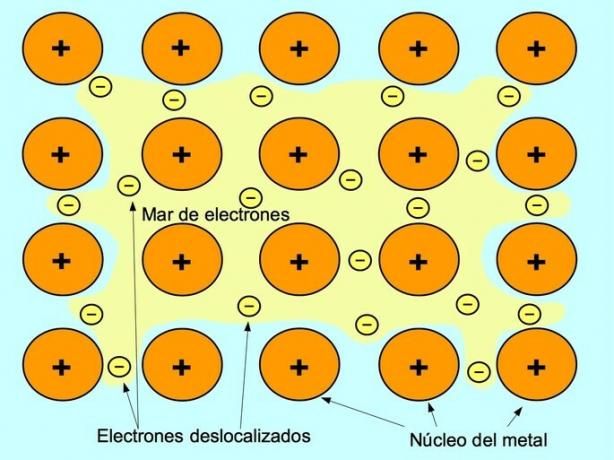
Legătura ionică este forța care unește un element metalic, cum ar fi sodiul sau magneziul, cu un element nemetalic, cum ar fi clorul sau sulful. Metalul pierde electroni și se transformă într-un ion metalic pozitiv numit cation. Acești electroni trec la elementul nemetalic și se transformă într-un ion încărcat negativ numit anion.
Cationii și anionii se combină și formează o rețea tridimensională care este menținută de forțele de atracție electrostatică între ioni cu sarcini diferite. Aceste forțe formează compuși ionici.
Crusta terestră este alcătuită în principal din compuși ionici. Cele mai multe roci, minerale și pietre prețioase sunt compuși ionici. De exemplu:
- Clorură de sodiu NaCl: elementul metalic este sodiul care transferă un electron către clor, care este elementul nemetalic.
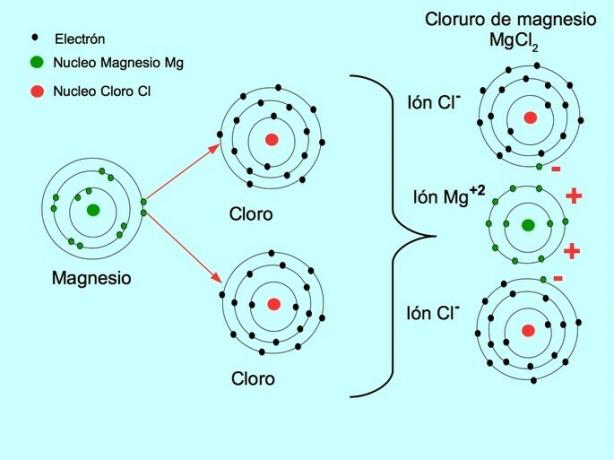
- Clorură de magneziu MgCl2: magneziu Mg donează doi electroni către doi atomi de clor, așa cum se arată în figura de mai jos:
Vezi si Diferența dintre cationi și anioni.
Legătură covalentă
Legătura covalentă se formează atunci când doi atomi nemetalici împart electroni. Această legătură poate fi de mai multe tipuri, în funcție de afinitatea pentru electronii atomilor și de cantitatea de electroni împărtășită.
Legătură covalentă nepolară
Legătura covalentă nepolară este legătura care se formează între doi atomi în care electronii sunt împărțiți în mod egal. Această legătură apare în mod normal în molecule simetrice, adică molecule formate din doi atomi egali, cum ar fi molecula de hidrogen H2 iar molecula de oxigen O2.

Legătură covalentă polară
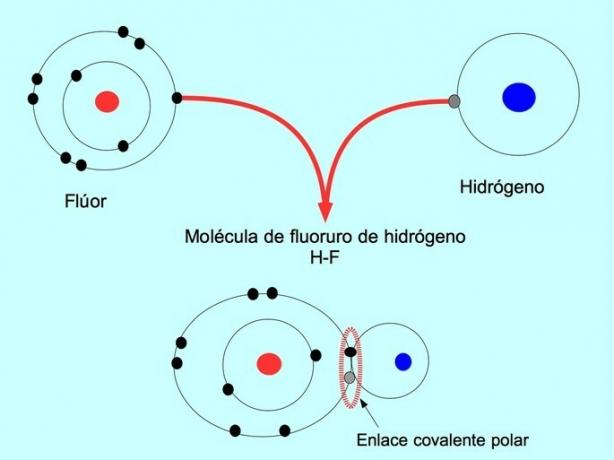
Legătura covalentă polară se formează atunci când doi atomi împart electroni, dar unul dintre ei are o atracție mai mare pentru electroni. Acest lucru face ca molecula să aibă un „pol” mai negativ, cu mai mulți electroni, iar polul opus este mai pozitiv.
Moleculele cu această distribuție sau dezechilibru de electroni sunt cunoscute sub numele de polare. De exemplu, în fluorura de hidrogen HF, există o legătură covalentă între hidrogen și fluor, dar fluorul are o electronegativitate mai mare, deci atrage electronii mai puternic impartit.
Legătură covalentă simplă
Când doi atomi împart doi electroni, unul din fiecare, legătura covalentă formată se numește o legătură covalentă simplă.
De exemplu, clorul este un atom care are șapte electroni de valență în învelișul său exterior, care poate fi umplut cu opt electroni. Un clor se poate combina cu un alt clor pentru a forma molecula de clor Cl2 care este mult mai stabil decât clorurile singure.
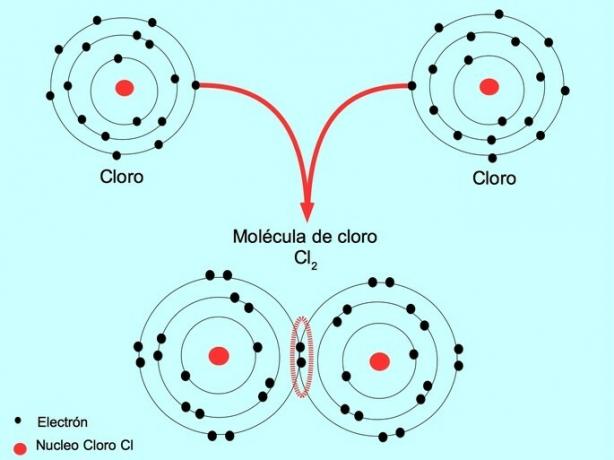
Dublă legătură covalentă
Legătura covalentă dublă este legătura în care patru electroni (două perechi) de electroni sunt împărțiți între doi atomi. De exemplu, oxigenul are 6 electroni în ultima sa coajă. Când doi oxigeni sunt combinați, patru electroni sunt împărțiți între cei doi, determinând fiecare să aibă 8 electroni în ultima coajă.
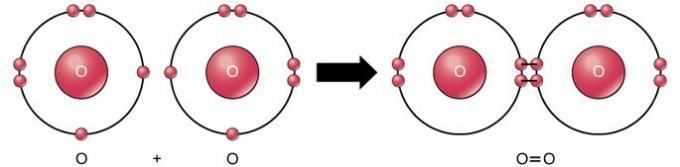
Legătură covalentă triplă
Legătura covalentă triplă se formează atunci când 6 electroni (sau trei perechi) sunt împărțiți între doi atomi. De exemplu, în molecula de cianură de hidrogen HCN, se formează o legătură triplă între carbon și azot, așa cum este prezentat în figura de mai jos:
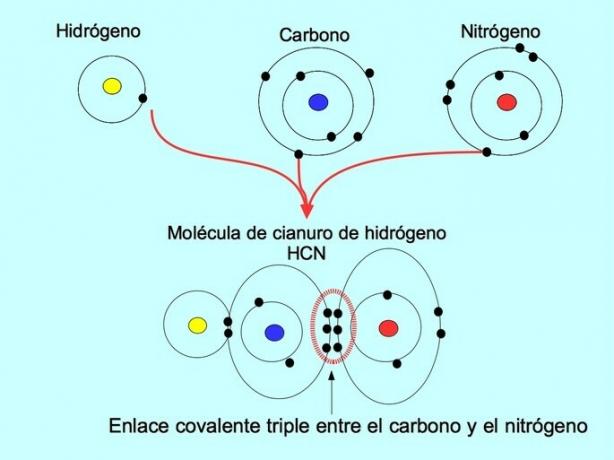
Legătură covalentă coordonată sau dativă
Legătura covalentă coordonată sau dativă este legătura care se formează atunci când doar unul dintre atomii din legătură contribuie la o pereche de electroni. De exemplu, când reacționează amoniacul NH3 cu trifluorură de bor BF3, Azotul se leagă cu doi electroni direct de bor, care nu are la dispoziție electroni de împărțit. În acest fel, atât azotul, cât și borul rămân cu 8 electroni în coaja lor de valență.
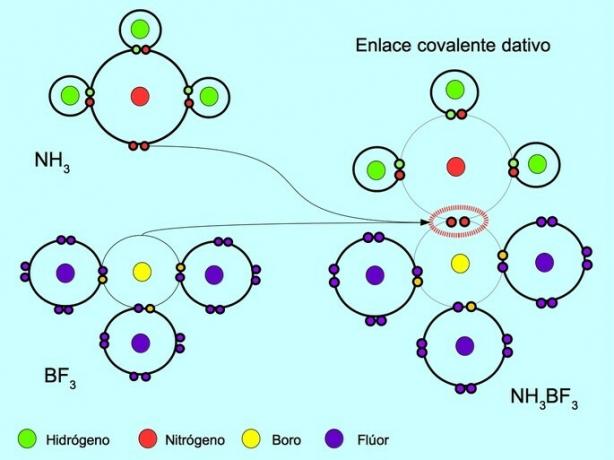
Vezi si Compuși organici și anorganici.
Legături intermoleculare
Moleculele se asociază prin forțe care fac posibilă formarea substanțelor în stare lichidă sau solidă.
Legături sau forțe dipol-dipol
Legături intermoleculare slabe pot fi stabilite între moleculele polare atunci când polii negativi sunt atrași de polii pozitivi și invers. De exemplu, metanal H2C = O este o moleculă polară, cu o sarcină parțială negativă asupra oxigenului și o sarcină parțială pozitivă asupra hidrogenilor. Latura pozitivă a unei molecule metanale atrage partea negativă a altei molecule metanale.
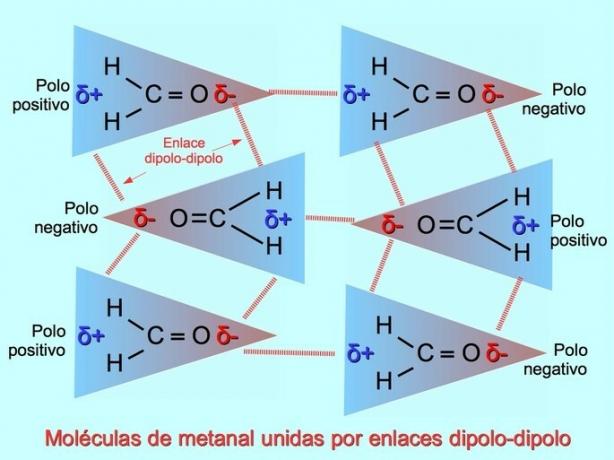
Legături sau legături de hidrogen
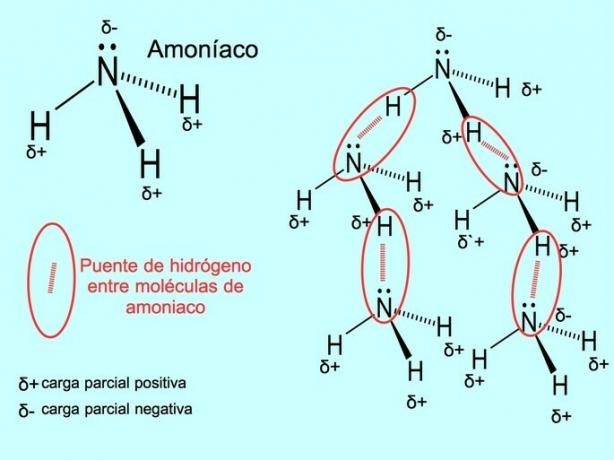
Legătura de hidrogen sau legătura de hidrogen este o legătură care se stabilește între molecule. Apare atunci când un hidrogen din moleculă este legat covalent de un oxigen, un azot sau un fluor. Oxigenul, azotul și fluorul sunt atomi cu electronegativitate mai mare, prin urmare, atrag electronii mai puternic atunci când îi împart cu un alt atom mai puțin electronegativ.
Există legături de hidrogen între moleculele de apă H2O și amoniac NH3 așa cum arată imaginea:
S-ar putea să fiți interesat să vedeți:
- Atomi și molecule.
- Exemple de compuși organici și anorganici.
- Metale și nemetale
Referințe
Zumdahl, S.S., Zumdahl, S.A. (2014) Chimie. Ediția a IX-a. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. Ediția a 5-a. Pearson Australia. Melbourne.