CARACTERISTICI PRINCIPALE ale ISOTOPILOR

Imagine: Planete
Toată materia care alcătuiește planeta noastră este alcătuită din atomi. Dar toți atomii nu sunt la fel, atomii din diferite elemente au un număr diferit de protoni, neutroni și electroni. Uneori numărul acestora particulele subatomice nu sunt la fel, nu sunt echilibrate și specii precum izotopi. Izotopii sunt atomi ai aceluiași element (de exemplu, hidrogen), dar care nu au același număr de neutroni. Acest "dezechilibru" provoacă caracteristicile izotopilor ale aceluiași element nu sunt egale. În această lecție de la un PROFESOR vom analiza în detaliu toate aceste caracteristici. Am inceput!
Index
- Ce este un izotop?
- Caracteristicile atomice ale izotopilor
- O aplicație curioasă a izotopilor: marcarea izotopică
- Caracteristicile izotopilor aceluiași element
Ce este un izotop?
Înainte de a vorbi despre caracteristicile izotopilor, este important să înțelegem mai bine în ce constă acest lucru. particula subatomică. Am putea spune care sunt izotopii
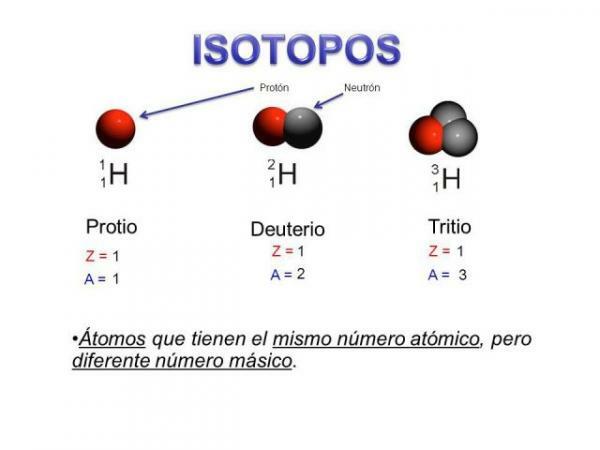
sunt „subgrupuri” de atomi: Sunt atomi de același element, dar care diferă în anumite lucruri.Izotopii sunt doi atomi cu același număr de protoni (același număr atomic), dar număr diferit de neutroni (masă atomică diferită). Izotopii aceluiași element sunt denumiți de obicei cu numele elementului urmat de masa sa atomică. Este bine cunoscut șil carbon paisprezece (C14), care este folosit pentru a determina vârsta fosilelor, dar carbonul are și alți izotopi, cum ar fi carbonul 12 și carbonul 13, care sunt mai stabile decât alți izotopi ai carbonului, cum ar fi carbonul 8 sau carbonul carbon 22.
În cazul nostru, toți acești atomi sunt atomi de carbon, deci au un număr atomic de 6 (Z = 6), dar carbon 12 (Carbonul „normal”) are o greutate atomică de 12 față de greutatea atomică de 14 de carbon 14 sau greutatea atomică de 8 de carbon C8.
Aceste diferențe între diferiții izotopi pot determina atomii să aibă caracteristici diferite, comportamente cu atomii altor elemente, perioade de înjumătățire etc.
Imagine: Sarcinile tale
Caracteristicile atomice ale izotopilor.
- Prima caracteristică a izotopilor la nivel atomic este că toți izotopii sunt atomi ai aceluiași element.
- Această caracteristică principală ne conduce la o a doua caracteristică: toți izotopii aceluiași element au același număr atomic, adică același număr de protoni.
- Toți izotopii unui element au același număr de protoni.
- Izotopii aceluiași element au un număr diferit de neutroni, adică număr de masă diferit sau masă atomică.

Imagine: EHU
O aplicație curioasă a izotopilor: marcarea izotopică.
Etichetarea izotopică este o tehnică care folosește două caracteristici foarte importante ale izotopilor: că toți izotopii reacționează în același mod în reacții chimice și pe care unii dintre ei o au radioactivitate.
În timpul unei reacții chimice, două sau mai multe substanțe, numiți reactivi, își combină atomii pentru a forma alte substanțe diferite rezultate din diferite combinații, așa-numitele produse. marcaj izotopic este o tehnică prin care putem introduce izotopul radioactiv al unui reactiv în reacție, astfel încât Acest lucru va reacționa într-un mod normal și îl putem localiza oricând datorită radioactivității care emite.
Alte variante ale acestei tehnici ne permit să identificăm diferiți izotopi ai unui reactiv prin spectrometrie de masă sau spectroscopie în infraroșu.

Imagine: Slideplayer
Caracteristicile izotopilor aceluiași element.
Ca o consecință a caracteristicilor atomice observate în secțiunea anterioară, izotopii aceluiași element pot avea alte tipuri de caracteristici, pe care le vom descrie mai jos.
- Izotopii aceluiași element au masă diferită. Proprietăți fizice precum densitate, care va fi diferit pentru diferiții izotopi ai aceluiași element.
- Anumit proprietăți chimice ele depind de tipul de element care este și, prin urmare, nu vor fi diferite pentru diferiții izotopi ai unui element. Un exemplu este solubilitate, ce va fi constant pentru toți izotopii unui element.
- Strâns legată de egalitatea lor în proprietățile chimice este următoarea caracteristică a izotopilor: izotopii aceluiași element reacționează în același mod în reacțiile chimice. Aceasta înseamnă că, dacă atomul de carbon 12 (cel mai comun sau cel mai normal) reacționează cu doi atomi de oxigen Pentru a forma molecula de dioxid de carbon, știm că și cei din ceilalți izotopi ai carbonului sunt ei vor. Aceasta este o proprietate foarte importantă pentru multe aplicații practice ale izotopilor și radioizotopilor.
- Izotopii unui element pot fi de origine naturală sau artificială. Dacă izotopul în cauză poate fi găsit în natură, fără ca mâna omului să fi intervenit în crearea sa, ne confruntăm cu un izotop natural, întrucât dacă a fost creat în reactoare nucleare, acceleratoare de particule sau generatoare de radioizotopi, spunem că este artificial. același element poate avea izotopi naturali și artificiali.
- Izotopii pot fi radioactive sau neradioactive. Izotopii radioactivi sunt cei în care există un exces de energie, pe care atomul tinde să-l elimine pentru a trece de la o stare instabilă la una de stabilitate.
- Legat de caracteristicile anterioare putem spune că izotopii radioactiv ei au o timp de viață variabil. Timpul de viață este timpul necesar pentru ca izotopul să se dezintegreze, adică să nu mai aibă acea energie în exces care o face instabilă. Există izotopi radioactivi care sunt foarte instabili și au o durată de viață de câteva secunde, în timp ce alții au nevoie de ore sau chiar ani pentru a se dezintegra și a deveni izotopi mai stabili. Atomii creați în mod artificial au o durată de viață sau decădere mult mai scurtă decât cei naturali.
Dacă doriți să citiți mai multe articole similare cu Caracteristicile izotopilor, vă recomandăm să introduceți categoria noastră de Atomul.
Bibliografie
- Briceño V, G. (s.f) Izotopi.
- Belmonte, A. (15 mai 2019). Proprietățile atomului.
- Wikipedia (22 octombrie 2019). Izotop.
