Diferența dintre reacțiile endoterme și reacțiile exoterme
A reacție endotermică necesită putere în timp ce a reacție exotermă eliberează energie. Această clasificare a reacțiilor chimice ia în considerare participarea energiei fie ca reactant, fie ca produs.
Energia este abilitatea de a lucra sau de a produce căldură. Amintiți-vă că reacțiile chimice implică o reorganizare a atomilor între substanțe cu ruperea sau formarea de legături chimice. În general, această formare sau ruperea legăturilor chimice este însoțită de modificări ale energiei sistemului.
| Reacție endotermică | Reacție exotermă | |
|---|---|---|
| Definiție | Reacție chimică în care energia este absorbită. | Reacție chimică în care energia este eliberată sub formă de căldură. |
| Originea energiei | De mediu | A sistemului |
| Energie potențială | Mai redus în reactanți decât în produse. | Mai mare în reactanți decât în produse. |
| Producție | Nu spontan | Spontan |
| Schimbarea energiei interne | ΔE> 0; schimbarea energiei interne mai mare de zero. | ΔE <0; schimbarea energiei interne mai mică de zero. |
| Temperatura | Scade | Crește |
| Exemple | Reacții în fotosinteză și sinteză în general. | Un meci arzător, reacții de ardere. |
Ce este o reacție endotermică?
O reacție chimică este endotermă atunci când absoarbe energia din mediu. În acest caz, căldura este transferată din exterior în interiorul sistemului. Când așezăm un termometru în timp ce are loc reacția endotermică, temperatura scade.
Cuvântul „endotermic” derivă din greacă endon care înseamnă „înăuntru” și terme ceea ce înseamnă „căldură”. Reacțiile endoterme nu au loc spontan.
De unde vine energia în reacțiile endotermice?
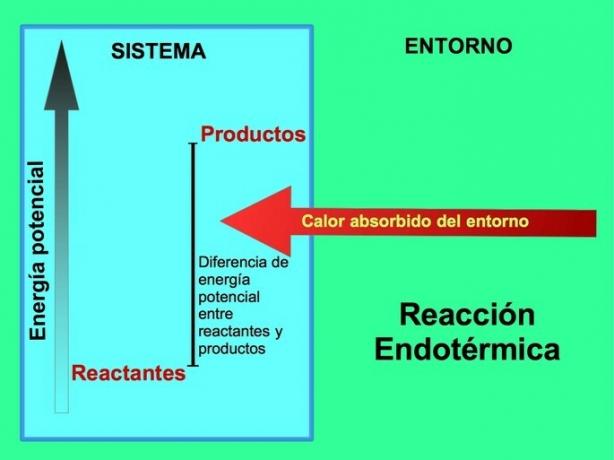
În reacțiile endotermice, energia provine din mediul din afara sistemului. Cantitatea de energie potențială a produselor este mai mare decât energia potențială a reactanților. Prin urmare, este necesar să se adauge energie reactanților pentru ca reacția să continue. Această energie provine din căldura mediului.
De exemplu, fotosinteza este un proces endoterm, unde plantele captează energia solară pentru a produce glucoză din dioxid de carbon și oxigen:

Produsele reacției de fotosinteză, glucoza și oxigenul, au o cantitate mai mare de energie potențială în raport cu reactanții, dioxidul de carbon și apa. Alte exemple de reacții chimice endoterme cu cantitatea de energie utilizată:

Exemple de reacție endotermică
Reacțiile apar nu numai în laboratorul de chimie. În fiecare zi, găsim și situații în care apar reacții endotermice.
Gătirea alimentelor
Deși poate nu pare, procesul de gătire a alimentelor este endoterm. Pentru a consuma anumite alimente, trebuie să oferim căldură.
Pungă rece instantanee
Pachetele reci folosite pentru a trata umflături sau entorse sunt umplute cu apă, dar atunci când sunt agitate sau lovite, o capsulă care conține azotat de amoniu se sparge în interior. Amestecarea azotatului de amoniu cu apa este o reacție endotermă, care determină răcirea pungii.
Ați putea fi interesat să vedeți Diferența dintre căldură și temperatură.
Ce este o reacție exotermă?
A reacția exotermă este una în care energia curge din sistem. Această energie este eliberată sub formă de căldură, astfel încât plasarea unui termometru în sistemul de reacție crește temperatura.
Cuvântul "exoterm" este format din exo ceea ce înseamnă „exterior” și terme, ceea ce înseamnă „căldură”. Reacțiile exoterme pot apărea spontan și, în unele cazuri, pot fi explozive, cum ar fi combinația de metale alcaline și apă.
De unde vine energia în reacțiile exoterme?
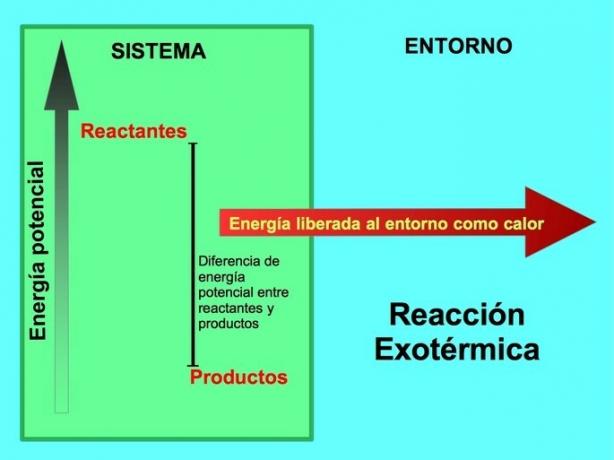
Într-o reacție chimică, reactanții sunt compușii care transformă și dau naștere produselor. De exemplu, când Na de sodiu reacționează cu clor Cl, aceștia sunt reactanții și produsul este clorura de sodiu NaCl:

Atât reactanții, cât și produsele au stocată energie potențială. Știm din lconservarea energiei ey că energia nu se pierde și nici nu se câștigă, deci energia reactanților trebuie să fie egală cu cea a produselor.
Într-o reacție exotermă, lreactanții au mai multă energie potențială în comparație cu produsele, deci excesul de energie este eliberat sub formă de căldură. În acest caz, energia este considerată, de asemenea, ca parte a produselor:

În orice proces exoterm, o parte din energia potențială stocată în legăturile chimice este transformată în energie termică prin căldură.
Exemple de reacție exotermă
Detergent de rufe
Când dizolvăm puțină pulbere de spălat cu apă în mâini, putem simți o ușoară încălzire.
Arderea gazelor domestice
Arderea gazelor de uz casnic, cum ar fi metanul sau butanul, implică reacția chimică cu oxigenul cu formarea de dioxid de carbon și apă și eliberarea de energie. Aceasta este o reacție exotermă tipică în utilizarea de zi cu zi:
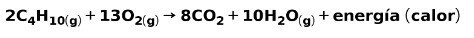
Energia eliberată în procesul de ardere este utilizată pentru a găti alimentele.
S-ar putea să fiți, de asemenea, interesat să știți care sunt acestea Sistem deschis, sistem închis și sistem izolat.

