Protoni, neutroni și electroni
Protonii, neutronii și electronii sunt particulele care alcătuiesc atomul, care este cea mai mică parte a elementului. Aceste particule determină caracteristicile și proprietățile elementelor chimice.
Protonii și neutronii sunt concentrați în nucleul atomic, în timp ce electronii sunt distribuiți în scoarță sau în periferia atomului. Un atom are același număr de electroni și protoni, în timp ce numărul de neutroni este variabil.
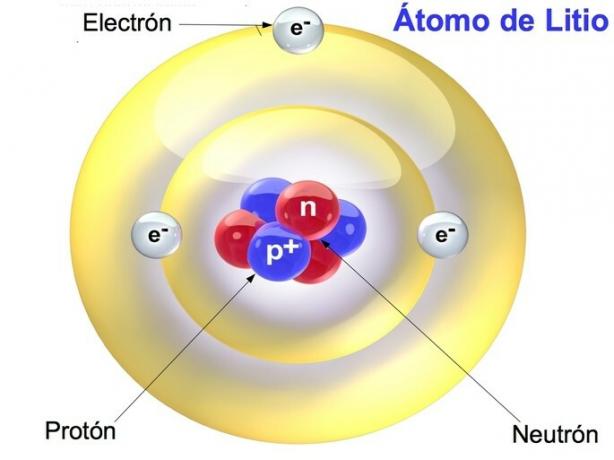
Apoi, prezentăm un tabel comparativ între protoni, neutroni și electroni.
| Proton | Neutron | Electron | |
|---|---|---|---|
| Definiție | Particulă subatomică de sarcină pozitivă | Particulă de încărcare neutră subatomică | Particulă subatomică încărcată negativ |
| Sarcină | Pozitiv +1 |
Neutru 0 |
Negativ -1 |
| Simbol | p+ | n0 | și- |
| Amplasarea în atom | Miezul | Miezul | Orbitalele periferice |
| Masă (kg) | 1.673 x 10--27kg | 1.675 x 10--27kg | 9.109 x 10--31kg |
| Masa comparativ cu protonul (amu) | 1 | 1 | 0,0005 |
| Particulă elementară | 3 cuarci: 2 u și 1 d | 3 cuarci: 2 d și 1 u | 1 lepton |
| Discoverer (an) | ȘI. Rutherford (1911) | J. Chadwick (1931) | J.J. Thomson (1897) |
Ce este un proton?
Protonii sunt particulele încărcate pozitiv găsite în nucleul unui atom. Fiecare atom al unui element are un număr fix de protoni, care determină numărul său atomic sau Z. Astfel, hidrogenul are un proton și Z este egal cu 1.
Masa protonului este de 1,673 x 10-27 kg, care reprezintă 1 unitate de masă atomică sau amu (pentru acronimul său în engleză unitate de masă atomică).
În 1911, Ernest Rutherford a descoperit că nucleul unui atom era mic și încărcat pozitiv, de unde și conceptul de proton.
Protonul este alcătuit din particule elementare numite quarks sau quarks: 2 quarks u (per sus= sus) și 1 cuarț d (de jos= jos).

Cum se calculează protonii unui atom?
Numărul de protoni dintr-un atom poate fi determinat din numărul său atomic, care este numărul poziției pe tabelul periodic.
De exemplu, aurul Au are un număr atomic = 79, ceea ce înseamnă că aurul are 79 de protoni în nucleul său.
Ce este un neutron?
Neutronii sunt particulele găsite în nucleul unui atom împreună cu protoni. Sunt notate cu litera n și sunt încărcate neutru. Singurul element care nu are neutroni este hidrogenul.
Masa neutronilor este foarte asemănătoare cu cea a protonilor, deci suma maselor de protoni și neutroni determină masa atomică a unui element.
Atomii care au același număr atomic, dar numere diferite de neutroni sunt numiți izotopi. De exemplu, deuteriul este un izotop al hidrogenului, care are un neutron și un proton în nucleu.
Fizicianul englez James Chadwick a descoperit în 1931 această particulă subatomică, cu o masă apropiată de proton, dar cu o sarcină electrică neutră, motiv pentru care a fost numită neutron.
Neutronul este compus ca protonul prin quarkuri: 1 quark u (by sus= sus) și 2 cuarț d (de jos= jos).
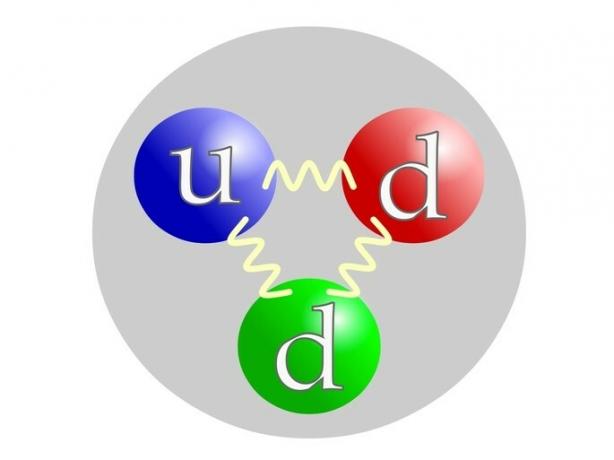
Cum se calculează neutronii unui atom?
Putem calcula numărul de neutroni dintr-un atom dacă știm masa sa atomică și numărul său atomic Z. Știm deja că numărul atomic Z este numărul de protoni și masa atomică este suma de protoni și neutroni pe care o are un atom.
De exemplu, oxigenul are o masă atomică de 16 și Z este 8. Numărul de protoni din oxigen este egal cu masa atomică minus Z:
16 - 8 = 8 neutroni
Ce este un electron?
Electronii sunt particulele atomului care se află în norul care înconjoară nucleul. În timp ce protonii și neutronii sunt concentrați în nucleu, electronii sunt distribuiți în straturi la exterior.
Electronii din coaja exterioară a unui atom pot sări de la un atom la altul. Acest lucru conferă atomului o încărcare electrică diferită; de exemplu, dacă un atom câștigă un electron, sarcina acestuia va fi negativă, în timp ce dacă pierde un electron, sarcina va fi pozitivă.
Așa se întâmplă în ioni, adică un atom care câștigă sau pierde unul sau mai mulți electroni. De exemplu, clorul are 17 electroni, dar poate câștiga un electron pentru a deveni un anion clorură de Cl.-, cu 18 electroni și o sarcină negativă.
Electronul a fost descoperit în 1897 de J.J. Thomson, același model al atomului de „budincă de stafide”
Electronul este alcătuit dintr-o particulă elementară care este leptonul.
Masa unui electron este de aproape 2000 de ori mai mică decât cea a protonului și a neutronului. Să presupunem că un proton sau un neutron au dimensiunea unei bile de bowling de 10 kilograme, atunci electronul ar avea dimensiunea unei mici marmuri.
Prin urmare, masa electronilor dintr-un atom este neglijabilă atunci când se calculează masa atomică.
Cum se calculează electronii unui atom?
Numărul de electroni dintr-un atom neutru este egal cu numărul de protoni din acel atom. De exemplu, aurul Au are 79 de protoni, prin urmare va avea 79 de electroni.
Ați putea fi, de asemenea, interesat să vedeți:
- Cationi și anioni
- Atomi și molecule.
Referințe
Myers, R.L. (2005) Bazele fizicii. Greenwood.
Peake, B.M. (1989) Descoperirea electronului, protonului și neutronului. J. Chemical Education 66: 738. DOI: 10.1021 / ed066p738



