Caracteristicile acizilor și bazelor: diferențe principale
Caracteristicile acizilor și bazelor sunt toate acele proprietăți și calități cu care putem distinge între un acid și o bază.
Conform teoriei lui Arrehnius, a acid este o substanță care eliberează protoni H+ când este dizolvat în apă și a baza este orice substanță care eliberează ioni hidroxil OH- când se află în soluție apoasă.
| Acizi | Bazele | |
|---|---|---|
| Formarea ionilor | Prezent | Prezent |
| Reacție de neutralizare | Când reacționează cu o bază. | Când reacționează cu un acid. |
| Solubilitatea apei | Solubil | Parțial solubil. Hidroxizii de calciu, bariu și aluminiu sunt slab solubili. |
| Conductivitatea electrică | Prezent | Prezent |
| Stare a materiei | Solid, lichid sau gazos | Solid, lichid sau gazos |
| Reacție cu hârtie de turnesol | Colorare roșie | Colorare albastră |
| valoare PH | Sub 7 ani | Mai mare de 7 |
| Conjugați omologul | Un acid slab formează o bază conjugată. | O bază slabă formează un acid conjugat. |
| Efect coroziv | Acizi tari | Baze puternice |
Caracteristicile acizilor
Acizii au mai multe caracteristici cu care pot fi identificați.
Capacitatea de a forma ioni din acizi
Principala caracteristică a substanțelor acide este că acestea pot fi ionizate, adică pot pierde sau câștiga electroni.
Acidul clorhidric HCI, un acid puternic, se ionizează pentru a forma anion clorură Cl- și protonul H+.
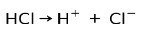
Reacție de neutralizare
Un acid reacționează cu o bază pentru a forma o sare și apă. Această reacție este cunoscută sub numele de reacție de neutralizare. De exemplu, HCI reacționează cu NaOH pentru a forma clorură de sodiu NaCl (sare de bucătărie) și apă:
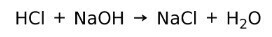
Solubilitatea în apă a acizilor
Acizii sunt în general solubili în apă. De exemplu, acidul clorhidric sau acidul muriatic sunt moderat solubile în apă, până la 82 g de HCI pot fi dizolvate în 100 ml de apă la 0 ° C. În cazul acidului sulfuric H2SW4, amestecul cu apă generează căldură, de aceea este întotdeauna recomandabil să adăugați acidul în apă pentru a evita exploziile.
Rezistența la acid
Modul în care se disociază acizii determină dacă sunt puternici sau slabi. Puterea unui acid este dată de constanta de disociere.
Acid azotic HNO3 e o acid puternic deoarece într-o soluție apoasă se ionizează complet în protoni și ioni nitrați:

Aceasta înseamnă că atunci când adăugăm HNO3 în apă, atunci când analizăm apa vom găsi doar H+ și ioni de nitrați, și practic fără HNO3.
În schimb, acidul acetic găsit în oțet este un acid slab, deoarece doar o parte din aceasta este disociată:
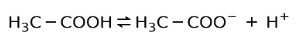
De aceea este reprezentat cu săgeți în două direcții, aceasta înseamnă că în soluție apoasă vom avea acid acetic, H+ și anionul acetat (H3C-COO-).
Stări ale materiei acizilor
Acizii pot fi găsiți în stare lichidă, solidă sau gazoasă. De exemplu, acidul clorhidric HCI este lichid, hidrogenul sulfurat HS este un gaz și acidul oxalic este un solid.
Reacție cu hârtie de turnesol din acizi

Când așezăm o fâșie de hârtie de turnesol într-o substanță acidă, hârtia de turnesol devine roșie.
Identificarea acizilor după pH-ul lor
PH este măsura cantității de H+ prezent într-o soluție. Astfel, între pH 0 și 7, suntem în prezența unui acid. De exemplu, oțetul are un pH egal cu 2, pH-ul acidului sulfuric din bateriile auto este egal cu 1.
Conductivitatea electrică a acizilor
Deoarece acizii se pot disocia și produce ioni încărcați electric, soluțiile acide pot conduce electricitatea. De exemplu, în interiorul bateriilor auto, acidul sulfuric, care este un acid puternic, este utilizat ca conductor de electricitate.
Efect coroziv al acizilor puternici
Acizii puternici au un efect coroziv, pot arde țesuturile organice, astfel încât manipularea lor trebuie să fie extrem de atentă.
Acizii slabi formează un omolog conjugat
Când se dizolvă, acizii slabi formează ceea ce este cunoscut sub numele de pereche conjugată, adică un acid slab formează o bază conjugată.
De exemplu:

În acest caz, acidul formic sau metanoic (HCOOH), atunci când este disociat, formează formatul ionilor bazici conjugați.
Vă poate interesa:
- Acizi și baze puternice și slabe.
- Exemple de acizi și baze.
Caracteristicile bazelor
În continuare prezentăm proprietățile bazelor sau soluțiilor alcaline care le caracterizează.
Capacitatea de ionizare de bază
Substanțele bazice sau alcaline se caracterizează prin formarea de ioni atunci când sunt dizolvați în apă:

În acest caz, hidroxidul de sodiu NaOH se ionizează pentru a forma un anion hidroxid OH- și un cation de sodiu Na+.
O bază reacționează cu un acid pentru a forma o sare
O bază reacționează cu un acid într-o reacție de neutralizare pentru a forma apă și o sare, de exemplu:

În acest caz, hidroxidul de aluminiu Al (OH)3, o bază, reacționează cu HCI și formează sarea de clorură de aluminiu AlCl3 si apa. Hidroxidul de aluminiu este utilizat ca antiacid pentru ameliorarea refluxului gastric prin neutralizarea acidului produs de stomac.
Baze solubilitate în apă
Unele baze sunt solubile în apă. Hidroxizii alcalino-pământoși, cum ar fi hidroxidul de calciu și hidroxidul de bariu, sunt slab solubili în apă. De exemplu, hidroxidul de sodiu sau soda caustică pot fi dizolvate 109 g în 100 ml apă la 20 ° C. În timp ce hidroxidul de magneziu sau laptele de magnezie Mg (OH)2 este practic insolubil în apă.
Rezistența bazei
În funcție de gradul de ionizare al bazei, acestea pot fi puternice sau slabe. De exemplu, hidroxidul de litiu este un baza puternica deoarece în soluție apoasă se ionizează complet în ioni hidroxid OH și cationi Li litiu+:
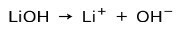
Pe de altă parte, amoniacul NH3 este un baza slaba pentru că atunci când intră în contact cu apa, nu tot amoniacul se disociază:
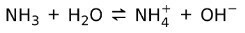
Starea materiei bazelor
Bazele pot fi găsite în stări solide, lichide și gazoase. De exemplu, hidroxidul de sodiu pur este solid, amoniacul este un gaz.
Reacția cu hârtia de turnesol a bazelor
Când așezăm o fâșie de hârtie de turnesol într-o substanță alcalină, hârtia devine albastră.
Identificarea bazelor după pH-ul lor
Bazele se caracterizează prin faptul că au un pH cuprins între 7 și 14.
 Conductivitatea electrică a bazelor
Conductivitatea electrică a bazelor
Bazele datorită capacității lor de ionizare sunt buni conductori de energie electrică. De exemplu, în bateriile alcaline, hidroxidul de potasiu KOH este utilizat ca conductor electric.
Efect coroziv al bazelor
Bazele puternice pot deteriora țesuturile organice. De exemplu, produsele de curățat cuptoare de bucătărie sunt în general baze puternice și este întotdeauna recomandat să le manipulați cu o îngrijire extremă, purtând mănuși și protecție pentru ochi.
Bazele slabe formează un omolog conjugat
Bazele slabe atunci când sunt dizolvate formează un omolog conjugat, adică o bază slabă formează un acid conjugat.
De exemplu, tris- (hidroximetil) amino metan (OHCH2)3CNH2 este o bază slabă al cărei acid conjugat este (OHCH2)3CNH3+:
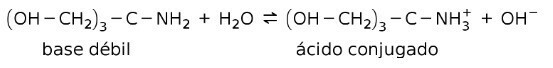
Aceasta este baza acțiunii substanțelor tampon sau tampon, care sunt substanțe care sunt utilizate pentru a menține constant pH-ul soluțiilor.
S-ar putea să fiți interesat să cunoașteți diferențele dintre:
- Acizi și baze.
- Cationi și anioni



