Структура и характеристики атома

Изображение: SlidePlayer
Атомы - это часть нашего мира. Вся материя состоит из атомов, поэтому важно лучше понять, из чего они состоят и каковы их функции. В этом уроке от УЧИТЕЛЯ мы расскажем вам, что структура атома и характеристики. Если вы хотите узнать больше о частицах, из которых состоит вся материя, продолжайте читать эту статью.
Индекс
- Что такое атомы?
- Строение атома
- Основные характеристики атома
- Что такое изотопы?
- Как атомы встречаются в природе?
Что такое атомы?
В атом это наименьшая единица, на которую можно разделить материю без потери своих химических свойств, то есть свойств как химического элемента. Атом - источник всего, что можно увидеть или потрогать, от звезд до вашего завтрака сегодня утром.
Если оставить в стороне потерю его химических свойств, можно сказать, что атом состоит из разных частиц, называемых субатомными частицами. Есть три типа субатомных частиц -протоны, нейтроны и электроны- с разными характеристиками.
Эти частицы сгруппированы по разному количеству и образуют химические элементы (кислород, углерод и т. Д.), Но они всегда будут распределяться по фиксированной структуре.

Изображение: Сайты Google
Строение атома.
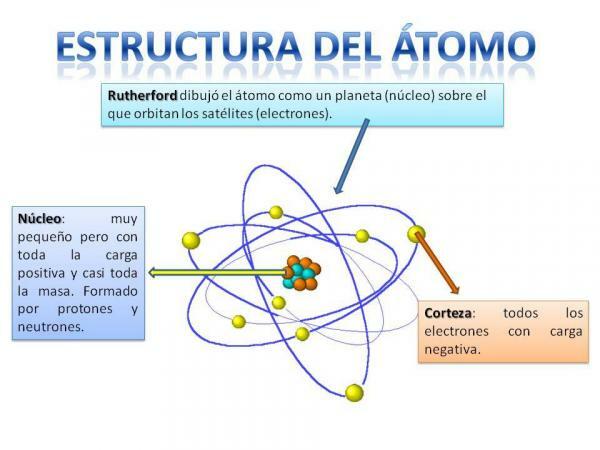
Структура атома зафиксирована, то есть у нас могут быть разные типы атомов (атом водорода, атом кислорода и т. д.), но их субатомные частицы всегда организованы аналогично планетной системе.
Вы наверняка вспомните, как устроена солнечная система: Солнце находится в центре и вокруг отсюда планеты вращаются, описывая разные орбиты, некоторые из которых ближе, а другие - дальше от Земли. Солнце. В случае атомов в центре находится основной, по форме похожий на ежевику и состоит из нейтроны и протоны.
Вокруг ядра находится Кора это область, через которую электроны. Раньше считалось, что электроны описывают определенные орбиты, аналогично тому, как это делают планеты, хотя теперь это знает, что эти орбиты не так четко определены и больше похожи на области, в которых мы с большей вероятностью окажемся электроны.
Изображение: REA - Plan Ceibal
Основные характеристики атома.
Чтобы продолжить этот урок о структуре и характеристиках атома, важно сосредоточиться на элементах, которые заставляют рассматривать атом как таковой.
И для этого мы должны ответить на вопрос: почему все атомы решают упорядочить себя определенным образом? Ответ прост: это связано с электрические силы притяжения. Ядро атома состоит из нейтронов, не имеющих электрического заряда, и протонов, имеющих положительный электрический заряд. и электроны имеют отрицательный электрический заряд, поэтому между ядром и электронами существует аналогичная сила притяжения. возникает между двумя полюсами магнита, но недостаточно силен, чтобы электроны «падали» на основной.
Это станет лучше, если мы примем во внимание размер ядра: если бы атом имел, например, размер футбольного стадиона, ядро имело бы размер мяча в центре с поля Какую силу притяжения должен придать футбольный мяч, чтобы упасть на него с трибуны стадиона!
Функция нейтронов
Теперь вам может быть интересно, а какую роль играют нейтроны? Несмотря на отсутствие электрического заряда, нейтроны играют важную роль в атоме: они составляют 99% массы. Если это поможет вам вспомнить, мы можем сказать, что атом подобен банде из трех друзей: тяжелые нейтрон, положительный протон и отрицательный электрон, который вращается вокруг нейтрона и электрон.
Движение электронов
На этом этапе я хочу, чтобы мы вернулись к тому, что мы оставили в чернильнице: орбитам, которые электроны описывают вокруг ядра. Мы сказали, что электроны вращаются вокруг ядра почему планеты делают это вокруг Солнца, некоторые ближе, чем другие? Электроны вращаются в той или иной оболочке в соответствии с энергией, которую они имеют для удаления от ядра, то есть те электроны, которые находятся ближе к ядру, не имеют силы, достаточной для того, чтобы отойти от ядра, в то время как те, что находятся во внешних (орбитальных) слоях коры, обладают большей энергией и могут двигаться дальше от ядра. основной. Кроме того, на каждой из орбиталей есть максимальная емкость 8 электронов (Правило октета).
Частицы атома
Мы собираемся вернуться к другому подходу, который мы использовали ранее, но не объяснили: атомы состоят из нейтроны, протоны и электроны, которые всегда сочетаются в соответствии с одной и той же структурой ядра и коры, но они делают это в разном количестве, чтобы сформировать разные химические элементы. Как мы можем получить такое количество элементов, объединив всего 3 типа частиц? Химические элементы, которые вы когда-либо видели в периодической таблице, характеризуются определенным атомным номером.
В атомный номер (Z) Он указывает количество протонов в ядре этого типа атомов, которое равно количеству электронов при нормальных условиях. Таким образом, например, все атомы, которые имеют 6 протонов (Z = 6), будут атомами углерода, и они будут иметь одинаковые химические свойства; атомы с 5 протонами (Z = 5) будут атомами бора с такими же химическими свойствами, что и друг друга, и отличными от свойств атомов углерода. Не нужно путать атомный номер с атомным весом или массовое число (А), который представляет собой сумму веса нейтронов и протонов (вес электронов незначителен по сравнению с весом всего ядра).

Изображение: SlidePlayer
Что такое изотопы?
В природе мы можем найти разные «подтипы» элементов, изотопы. Я уверен, что в какой-то момент вы слышали об углероде 14, радиоактивном изотопе углерода, который используется, среди прочего, для определения возраста окаменелостей. Изотопы два атома с одинаковым числом протонов (тот же атомный номер), но разное количество нейтронов (разная атомная масса). Изотопы одного и того же элемента обычно называют именем элемента, за которым следует его атомная масса.
В нашем примере оба изотопа являются углеродом, поэтому они имеют атомный номер 6 (Z = 6), но углерод 12 («нормальный» углерод) имеет атомный вес 12 по сравнению с атомным весом углерода 14. 14. Изотопы одного и того же элемента имеют очень похожие химические и физические свойства. В случае углерода 14, в отличие от углерода 12, это радиоактивный изотоп, который присутствует во всех элементах, содержащих углерод, включая живые существа.
На этом мы завершаем урок о строении атома и его характеристиках. Мы надеемся, что это было полезно для вас.

Изображение: Ваши задачи
Как атомы встречаются в природе?
Атомы можно найти изолированно, но самое нормальное - найти их объединены в группы называется молекулы.
Молекулы могут состоять из атомов одного и того же элемента (например, молекулы кислорода, состоящей из двух атомов кислорода) или группами с атомами разных элементов (два атома водорода и один кислород образуют молекулу Воды). Эти группы элементов называются молекулами, которые, в свою очередь, могут сочетаться друг с другом и образуя различные все более и более сложные группы в зависимости от их реакционной способности и их химического сродства к источник химические связи.
Если вы хотите прочитать больше статей, похожих на Структура и характеристики атома, рекомендуем вам войти в нашу категорию Атом.
