Характеристики кислот и оснований: основные отличия
Характеристики кислот и оснований - это все те свойства и качества, по которым мы можем различать кислоту и основание.
Согласно теории Аррехниуса, кислота вещество, выделяющее протоны H+ при растворении в воде и база любое вещество, выделяющее гидроксильные ионы ОН- в водном растворе.
| Кислоты | Базы | |
|---|---|---|
| Образование ионов | Настоящее время | Настоящее время |
| Реакция нейтрализации | Когда реагирует с основанием. | Когда реагирует с кислотой. |
| Растворимость воды | Растворимый | Частично растворим. Гидроксиды кальция, бария и алюминия плохо растворимы. |
| Электропроводность | Настоящее время | Настоящее время |
| Состояние вопроса | Твердый, жидкий или газообразный | Твердый, жидкий или газообразный |
| Реакция с лакмусовой бумажкой | Красная окраска | Голубая окраска |
| Значение PH | До 7 лет | Больше 7 |
| Сопряженный аналог | Слабая кислота образует сопряженное основание. | Слабое основание образует сопряженную кислоту. |
| Коррозионный эффект | Сильные кислоты | Сильные базы |
Характеристики кислот
Кислоты имеют несколько характеристик, по которым их можно идентифицировать.
Способность образовывать ионы из кислот
Основная характеристика кислых веществ заключается в том, что они могут ионизироваться, то есть терять или приобретать электроны.
Соляная кислота HCl, сильная кислота, ионизируется с образованием хлорид-аниона Cl- и протон H+.
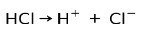
Реакция нейтрализации
Кислота реагирует с основанием с образованием соли и воды. Эта реакция известна как реакция нейтрализации. Например, HCl реагирует с NaOH с образованием хлорида натрия NaCl (кухонная соль) и воды:
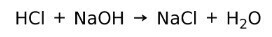
Растворимость кислот в воде
Кислоты обычно растворимы в воде. Например, соляная кислота или соляная кислота умеренно растворимы в воде, до 82 г HCl можно растворить в 100 мл воды при 0ºC. В случае серной кислоты H2ЮЗ4, смесь с водой выделяет тепло, поэтому всегда рекомендуется добавлять кислоту в воду, чтобы избежать взрывов.
Кислотная сила
То, как диссоциируют кислоты, определяет, сильные они или слабые. Сила кислоты определяется ее константа диссоциации.
Азотная кислота HNO3 это сильная кислота потому что в водном растворе он полностью ионизируется на протоны и нитрат-ионы:

Это означает, что когда мы добавляем HNO3 в воде, анализируя воду, мы найдем только H+ и нитрат-ионы, и практически без HNO3.
Вместо этого уксусная кислота, содержащаяся в уксусе, является слабая кислота, потому что только часть диссоциирована:
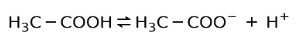
Поэтому он изображен стрелками в двух направлениях, это означает, что в водном растворе у нас будет уксусная кислота, H+ и ацетат-анион (H3C-COO-).
Состояния вещества кислот
Кислоты могут быть в жидком, твердом или газообразном состоянии. Например, соляная кислота HCl является жидкостью, сероводород HS - газом, а щавелевая кислота - твердым веществом.
Реакция с лакмусовой бумажкой от кислот

Когда мы помещаем полоску лакмусовой бумаги в кислое вещество, лакмусовая бумага становится красной.
Идентификация кислот по их pH
PH - это мера количества H+ присутствует в растворе. Таким образом, при pH от 0 до 7 мы находимся в присутствии кислоты. Например, уксус имеет pH равный 2, pH серной кислоты в автомобильных аккумуляторах равен 1.
Электропроводность кислот
Поскольку кислоты могут диссоциировать и производить электрически заряженные ионы, кислотные растворы могут проводить электричество. Например, внутри автомобильных аккумуляторов серная кислота, которая является сильной кислотой, используется как проводник электричества.
Коррозионное действие сильных кислот
Сильные кислоты оказывают разъедающее действие, они могут обжечь органические ткани, поэтому при обращении с ними необходимо соблюдать особую осторожность.
Слабые кислоты образуют конъюгированный аналог
При растворении слабые кислоты образуют так называемую конъюгированную пару, то есть слабая кислота образует конъюгированное основание.
Например:

В этом случае муравьиная или метановая кислота (HCOOH) при диссоциации образует формат сопряженного основного иона.
Вас может заинтересовать:
- Сильные и слабые кислоты и основания.
- Примеры кислот и оснований.
Характеристики оснований
Далее мы представляем свойства оснований или щелочных растворов, которые их характеризуют.
Базовая ионизационная способность
Основные или щелочные вещества характеризуются образованием ионов при растворении в воде:

В этом случае гидроксид натрия NaOH ионизируется с образованием гидроксид-аниона OH.- и катион натрия Na+.
Основание реагирует с кислотой с образованием соли.
Основание реагирует с кислотой в реакции нейтрализации с образованием воды и соли, например:

В этом случае гидроксид алюминия Al (OH)3, основание, реагирует с HCl и образует соль хлорида алюминия AlCl3 и вода. Гидроксид алюминия используется в качестве антацида для облегчения желудочного рефлюкса путем нейтрализации кислоты, вырабатываемой желудком.
Основы растворимости в воде
Некоторые основания растворимы в воде. Гидроксиды щелочноземельных металлов, такие как гидроксид кальция и гидроксид бария, плохо растворимы в воде. Например, гидроксид натрия или едкий натр можно растворить 109 г в 100 мл воды при 20ºC. В то время как гидроксид магния или молоко магнезии Mg (OH)2 практически не растворяется в воде.
Базовая сила
В зависимости от степени ионизации основания они могут быть сильными или слабыми. Например, гидроксид лития представляет собой сильная база потому что в водном растворе он полностью ионизируется на ионы гидроксида ОН и катионы лития Li.+:
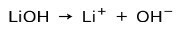
С другой стороны, аммиак NH3 это слабая база потому что при контакте с водой не весь аммиак диссоциирует:
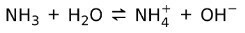
Состояние оснований
Основания бывают в твердом, жидком и газообразном состояниях. Например, чистый гидроксид натрия - твердое вещество, аммиак - газ.
Реакция с лакмусовой бумажкой основ
Когда мы помещаем полоску лакмусовой бумаги в щелочное вещество, бумага становится синей.
Идентификация оснований по их pH
Основания характеризуются значением pH от 7 до 14.
 Электропроводность оснований
Электропроводность оснований
Основания благодаря своей ионизационной способности хорошо проводят электричество. Например, в щелочных батареях в качестве электрического проводника используется гидроксид калия КОН.
Коррозионное действие оснований
Сильные основания могут повредить органические ткани. Например, средства для чистки кухонных духовок обычно представляют собой сильную основу, и всегда рекомендуется обращаться с ними с особой осторожностью, используя перчатки и средства защиты глаз.
Слабые основания образуют сопряженный аналог
Слабые основания при растворении образуют сопряженный аналог, то есть слабое основание образует сопряженную кислоту.
Например, трис- (гидроксиметил) аминометан (OHCH2)3CNH2 представляет собой слабое основание с сопряженной кислотой (OHCH2)3CNH3+:
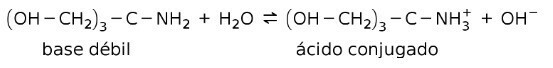
Это основа действия буферных веществ или буфер, которые являются веществами, которые используются для постоянного поддержания pH растворов.
Возможно, вам будет интересно узнать о различиях между:
- Кислоты и основания.
- Катионы и анионы



