Что такое ХИМИЧЕСКИЕ ФОРМУЛЫ и для чего они нужны [РЕЗЮМЕ + ВИДЕО]
Хотя это не кажется, химические элементы периодической таблицы Они окружают нас со всех сторон. Однако во многих случаях они не находятся отдельно, а образуют молекулы или макромолекулы различных химических элементов. Химические формулы являются графическим выражением этих соединений и используются для стандартизации их номенклатуры. В этом уроке УЧИТЕЛЯ мы увидим что такое химические формулы и для чего они. Присоединяйтесь к нам, чтобы узнать больше!
В химические формулы являются графическим выражением элементов, составляющих химические соединения.
Эти химические формулы не произвольны, но следуют некоторым строгие правила химической номенклатуры, установленной ИЮПАК (Международный союз теоретической и прикладной химии).
Химические формулы также предоставляют нам информацию о элементы, составляющие молекулу, таким образом, например, он сообщает нам количество и соответствующие пропорции каждого из атомов, составляющих его, а иногда даже тип Химическая связь который существует между этими элементами.
Каждая существующая молекула или макромолекула соответствует своей химической формуле, однако есть разные типы формул. Каждый из этих типов дает нам разную информацию о молекуле, но все они помогают нам понять ее химическая природа и это помогает нам понять, что происходит в химических реакциях и как одно соединение может превращаться в другое.
Но чтобы понять эту химическую номенклатуру, необходимо иметь определенные знания в области химии, поскольку они подчиняются довольно специализированному техническому языку.

Изображение: Slideplayer
В химические формулы представлены объединение химических символов, с соответствующей буквой каждого атома, как он входит в периодическая таблица, и нижние индексы, которые представляют собой числа, которые представляют количество этих атомы в молекуле
В химии (как органической, так и неорганической) есть определенные фрагменты или соединения, которые проявляют определенную повторяемость как структурную, так и функциональную и идентифицируются по именам специфический. Когда эти фрагменты имеют свободные электроны, которые не являются общими, их называют радикалами, и они являются нестабильными, высокореактивными соединениями с коротким периодом полураспада.
Примеры радикалов: метильные группы CH3, нитратные группы NO3, гидроксильные группы OH- или радикал Cl-. Однако они известны как функциональные группы, когда они представляют собой атомы или группы атомов, присоединенные к цепи. двуокись углерода (с различным углеродом), которые отвечают за реакционную способность и химические свойства молекулы.
Эти группы особенно важны в органической химии (биомолекулы человека в основном состоят из углерода и водорода). Некоторые примеры функциональных групп карбонильная группа = C = O или карбоксильная группа -COOH.

Изображение: Monogramas.com
Как мы уже сказали, есть несколько типов химических формул. Каждая из этих формул дает нам разную информацию о молекулах и, следовательно, он служит определенной цели, и ни одна из формул в общих чертах не лучше или хуже другой.
Мы выделяем следующие классы химических формул:
Эмпирические формулы
Эмпирические формулы - это простейшие формулы для представления химической молекулы, иногда говорят, что это минимальные формулы. Эти формулы представляют собой пропорции атомов каждого из элементов в молекуле, которые упрощены до целых чисел, всегда наименьших. Примером этой формулы является CH3 (метильная группа) с тремя атомами водорода и одним атомом углерода.
Однако эти формулы иногда могут привести к неправильным представлениям о составе молекулы. Это происходит, когда формула не указывает фактическое количество атомов в молекуле, как в случае пероксида. водорода, эмпирическая формула которого - HO, тогда как формула должна быть H2O2 (два атома водорода и два атома водорода). кислород). Таким образом, это происходит в соответствии с соглашением о номенклатуре, поскольку оба нижних индекса равны, они упрощены.
Однако некоторые соединения могут быть представлены только эмпирическими формулами, поскольку они состоят из ионных сетей. Это происходит, например, с поваренной солью или хлоридом натрия, который представлен как NaCl, что указывает на то, что для каждого натрия существует хлор.
Молекулярные формулы
Эти типы формул довольно просты, они просто выражают тип атомов и количество каждого из них, присутствующего в ковалентной молекуле. Это формулы, в которых химические элементы и числа представлены линейным образом (в виде нижнего индекса. Примером формулы этого типа является название глюкозы C6H12O6, которое выражает эту глюкозу. Молекула глюкозы состоит из шести атомов углерода, двенадцати атомов водорода и шести атомов углерода. кислород.
Молекулярные формулы широко используются, иногда говорят, что это истинные формулы молекул. Во многих случаях они совпадают с эмпирическими формулами, например, для CO2.
Полуразработанные формулы
Полуразработанные формулы представляют собой тип формул, подобных молекулярным формулам, поскольку они также выражают атомы, составляющие молекулу, и их количество, а также предоставить информацию о химических связях (представленных линиями между атомами) и типе связи между атомами углерода, которые ее образуют (если они простые, двойные или троек). Полуразработанная формула полезна для идентификации радикалов, составляющих молекулу, и ее химической структуры (связи между атомами углерода и водорода не представлены).
В случае глюкозы ее полуразработанная формула - CH2OH - CHOH - CHOH - CHOH -CHOH - CHO, и, как можно видеть, атомы углерода, водорода и кислород такие же, как в молекулярной формуле (шесть, двенадцать и шесть соответственно) и все одинарные связи (глюкоза имеет только связи просто). Таким образом, эта формула является более сложной формулой, чем молекулярная формула.
Полуразработанные формулы иногда называют сокращенными и, возможно, являются наиболее широко используемым классом формул. используются, особенно в органической химии, хотя они не позволяют нам наблюдать реальную геометрию молекул.
Разработанная формула
Разработанные формулы немного сложнее полуразработанных. В формулах этого типа связь и расположение каждого атома в молекуле представлены в декартовой плоскости, пока не будет представлено все соединение.
Структурная формула
Структурная формула - это графическое изображение структуры молекулы в пространстве, дающее нам информацию о порядке и распределении атомов в пространстве. В этой формуле также показаны химические связи, составляющие молекулу, одинарные, двойные или тройные. Таким образом, эта формула дает нам больше всего информации о молекуле.
Эти типы формул больше используются на профессиональном уровне в мире химии, поскольку они позволяют более четко видеть химические реакции или синтез новых молекул.
Формулы Льюиса
Это сложные, очень конкретные и технические формулы. Они также известны как диаграммы или структуры Льюиса и похожи на разработанные формулы молекул, но Кроме того, указаны электроны, которые атомы разделяют в каждой химической связи, которые меняются в зависимости от валентности атомов. вовлеченный.
В этих формулах связи между атомами представлены линиями (также указывающими, являются ли они одинарными, двойными или тройными) или парой точек. Одиночные электроны или электроны, которые не являются общими для связи, представлены точками вокруг атома, которому она соответствует.

Изображение: Органическая химия
При написании формул иногда делается ссылка настепень окисления элемента (часто в ионных соединениях). Это набор положительных и отрицательных чисел, которые идут связанный с каждым элементом.
- Степени окисления можно интерпретировать как количество электронов что элемент разделяет ковалентную связь или передает ионную связь.
- Когда знак окисления над атомом отрицательный, означает, что этот элемент захватывает электроны, а число, которое сопровождает его рядом с ним, является числом захваченных электронов. Следовательно, степень окисления -1 означает, что элемент улавливает один электрон, -2 - два и так далее.
- Когда признак окисления положительный, атом отдает электрон, и число, которое сопровождает этот знак, - это количество отданных электронов. Точно так же степень окисления +1 означает, что он дает один электрон, +2, что дает два, и так далее.
Это работает в основном для ионные соединения, в ковалентных связях, хотя интерпретация аналогична, это не то же самое, поскольку эти связи разделяют электроны. В этих соединениях мы говорим о большем количестве электроотрицательных элементов, которые притягивают большую часть электронной пары и остаются с более отрицательным зарядом, в зависимости от количества электронов, которые они притягивают. Это можно увидеть в Формулы Льюиса.
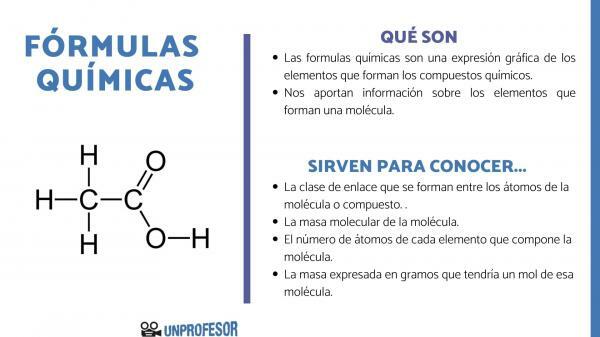
Если вы хотите знать, для чего нужны химические формулы, вы должны принять во внимание, что это число позволяет нам получить некоторые информация о молекуле, как они есть:
- В класс ссылки которые образуются между атомами молекулы или соединения. Эти связи обычно ковалентны, если в них участвуют неметаллические и ионные атомы, если они являются металлическими и неметаллическими связями.
- В молекулярная масса молекулы.
- В количество атомов каждого элемента, составляющего молекулу. Иногда его называют сотенным составом молекулы.
- Масса, выраженная в граммы что будет иметь один моль этой молекулы.
В случае ионного соединения, например хлорида натрия или поваренной соли, это не совсем правильно. говорить о молекулах (хотя иногда это делается), что они имеют тенденцию образовывать большие агрегаты и макромолекулы. В этом случае формула соединения помогает нам увидеть, какие ионы его образуют и в каком количестве.



