Ugotovite, kje so elektroni v ATOM-u

Elektroni so subatomski delci, ki se vrtijo okoli atomskega jedra v elektronskem oblaku, imenovanem elektronska skorja. V tej lekciji učitelja bomo videli kje so elektroni znotraj atomske strukture, pa tudi obnašanje elektronov v različnih stanjih atomov (stanje tal in vzburjenosti), ko nastanejo atomi monatomski ioni in kadar elektroni niso vezani na noben določen atom.
Kazalo
- Kaj so elektroni in kje jih najdemo?
- Kako vedeti, kaj so valentni elektroni?
- Elektroni atoma: osnovno stanje in stanje vzbujanja
- Pridobivanje ali izguba elektrona: Monatomska tvorba ionov
- Elektroni v gibanju: električni tok
Kaj so elektroni in kje jih najdemo?
The elektroni Vem najti v notranjosti od atomiki so najmanjše enote, ki tvorijo snov. Atomi so nedeljivi, njihova struktura in sestava pa določajo značilnosti materialov.
Atomi so sestavljeni iz treh vrst subatomski delci:
- Protoni: so delci z maso in pozitivnim nabojem
- Nevtroni: so delci z maso in brez električnega naboja
- Elektroni: So brez mase in negativno nabiti delci.
Protoni in nevtroni so del jedra atoma, tako da atomsko jedro koncentrira vso maso in pozitivni naboj atoma.
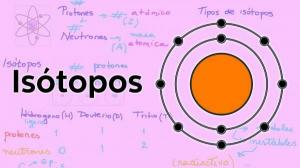
Po drugi strani pa se elektroni vrtijo okoli jedra v določenih orbitah in tvorijo elektronski oblak, imenovan elektronska skorja. Elektronska lupina atoma koncentrira ves negativni naboj in nima mase.
Elektronske orbite
Orbite, ki jih elektroni opisujejo okoli atomskega jedra, so določene vnaprej določene orbite. To pomeni, da poti elektronov okoli atomskega jedra niso naključne. V elektronski lupini je le nekaj možnih orbit za elektrone; medtem ko so druge orbite prepovedane. je opredeljeno kot atomska orbitala tisto območje okoli jedra, v katerem je verjetnost iskanja elektrona večja od 90%.
V vsaki od teh možnih orbital elektron, ki kroži skozi njo, pridobi določeno energijo, ki se poveča, ko so orbitale bolj oddaljene od jedra. Orbitale so združene v različne ravni energije (n) ali plasti obstaja skupno 7 nivojev energije, pri čemer je n = 1 najnižja raven energije in najbližja jedru atoma. V vsaki energijski ravni ali plasti so različne vrste orbitalov (s, p, d in f orbitale)
Ureditev, v kateri so elektroni porazdeljeni v različnih energijskih nivojih in orbitalah v atomu, je znana kot elektronska konfiguracija.

Slika: Slideplayer
Kako vedeti, kaj so valentni elektroni?
Fizikalne in kemijske lastnosti atomov določajo njihova sestava in zlasti elektronska konfiguracija najbolj zunanja plast (valentna plast).
Kemični elementi so različne vrste atomov, ki obstajajo in jih določa njihovo atomsko število (Z) in masno število (A).
- Atomska številka (Z): število protonov atomskega elementa, ki je enako številu elektronov, če je atom nevtralen.
- Masno število (A): število delcev z maso atomskega elementa, to je vsota delcev atomskega jedra (protoni plus nevtroni).
Vsakemu elementu je dodeljen a kemični simbol ki ga predstavlja in sklop vseh je naveden v znanstvenem dokumentu, ki ga uredi glede na njihovo atomsko število in jih razvrsti glede na njihove značilnosti v družine in skupine afinov: Periodična tabela.

Elektroni atoma: osnovno stanje in stanje vzbujanja.
V temeljna država, ki je opredeljeno kot stanje minimalne energije in največje stabilnosti atoma; elektroni niso naključno porazdeljeni v različnih atomskih orbitalah, ampak zasedajo različne orbitale urejeno, vedno najprej polnijo, nižje orbitale brez energije.
V tem stanju ima atom enako število elektronov kot protoni in pozitivni in negativni naboj se medsebojno kompenzirata, zato je atom kot celota nevtralen (nima neto naboja).
Vendar pa elektroni lahko skoči z ene orbitale na drugo oddajanje ali absorbiranje energije. Ko elektroni atoma ne zapolnijo orbital urejeno, se reče, da je atom v njem vznemirjeno stanje. V stanju vzbujanja en ali več elektronov zaseda orbitale z višjo energijo, drugi pa prazne z nižjo energijo. V vzbujenem stanju so atomi zelo nestabilni in se ponavadi hitro vrnejo v osnovno stanje.
Pri spreminjanju orbite elektron oddaja ali absorbira energijo. Če elektron skoči z nižje energetske orbite na višjo, bo atom absorbiral energijo; Medtem ko je skok narejen v nasprotni smeri (od orbite višje energije do ene nižje energije), bo atom sprostil energijo.

Izguba ali pridobitev elektronov: tvorba monatomskih ionov.
Elektroni v najbolj zunanji lupini elektronske skorje (imenovani valentna lupina) so elektroni, ki lahko zapustijo atom ali pa jih je mogoče vključiti za to. Na ta način lahko atom pridobi ali izgubi elektrone.
V nevtralni atom število protonov v jedru je enako številu elektronov, ki tvorijo njegovo elektronsko lupino. To pomeni, da je število pozitivnih nabojev enako številu negativnih nabojev. Ko pride do dobička ali izgube elektronov, nastanejo atomi monatomski ioni.
Vrste monatomskih ionov
Glede na naboj iona ločimo dve vrsti:
- Monatomski kationi: atomi, ki so izgubili enega ali več elektronov, tako da del pozitivnega naboja jedra ni kompenziran. Zato atom dobi neto pozitivni naboj.
- Monatomski anioni: atomi, ki so pridobili enega ali več elektronov, tako da je število elektronov večje od števila protonov v jedru, tako da atom dobi neto negativni naboj.

Elektroni v gibanju: električni tok.
Ko elektroni niso vezani na noben atom zlasti se gibljejo po prostem prostoru med atomi. To neodvisno gibanje elektronov tvori tok električnega naboja, ki lahko potuje skozi določene materiale (prevodni in polprevodniški materiali).
To se na primer zgodi v primeru električni tok ki napaja stavbe, vozila itd.
Če želite prebrati več podobnih člankov Kje so elektroni?, priporočamo, da vnesete našo kategorijo Atom.
Bibliografija
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Osnovna kemija. Madrid: Uned