Značilnosti kislin in baz: glavne razlike
Značilnosti kislin in baz so vse tiste lastnosti in lastnosti, s katerimi lahko ločimo kislino in bazo.
Po Arrehniusovi teoriji je a kislina je snov, ki sprošča protone H+ ko se raztopi v vodi, in a osnova je katera koli snov, ki sprošča hidroksilne ione OH- v vodni raztopini.
| Kisline | Baze | |
|---|---|---|
| Nastajanje ionov | Prisoten | Prisoten |
| Nevtralizacijska reakcija | Ko reagira z bazo. | Ko reagira s kislino. |
| Topnost v vodi | Topno | Delno topen. Kalcijevi, barijevi in aluminijevi hidroksidi so slabo topni. |
| Električna prevodnost | Prisoten | Prisoten |
| Stanje snovi | Trdna, tekoča ali plinasta | Trdna, tekoča ali plinasta |
| Reakcija z lakmusovim papirjem | Rdeča barva | Modra barva |
| Vrednost PH | Pod 7 let | Več kot 7 |
| Konjugirani dvojnik | Šibka kislina tvori konjugirano bazo. | Šibka baza tvori konjugirano kislino. |
| Jedko delovanje | Močne kisline | Močne podlage |
Značilnosti kislin
Kisline imajo več značilnosti, s katerimi jih je mogoče identificirati.
Sposobnost tvorjenja ionov iz kislin
Glavna značilnost kislih snovi je, da jih je mogoče ionizirati, torej izgubiti ali pridobiti elektrone.
Klorovodikova kislina HCl, močna kislina, se ionizira in tvori kloridni anion Cl- in protona H+.
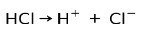
Nevtralizacijska reakcija
Kislina reagira z bazo in tvori sol in vodo. Ta reakcija je znana kot reakcija nevtralizacije. Na primer, HCl reagira z NaOH in tvori natrijev klorid NaCl (kuhinjska sol) in vodo:
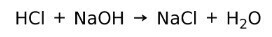
Topnost kislin v vodi
Kisline so na splošno topne v vodi. Na primer, klorovodikova ali muriatska kislina je zmerno topna v vodi, v 100 ml vode pri 0 ° C lahko raztopimo do 82 g HCl. V primeru žveplove kisline H2SW4, mešanica z vodo ustvarja toploto, zato je kislino vedno priporočljivo dodati v vodo, da se izognemo eksplozijam.
Moč kisline
Način ločevanja kislin določa, ali so močne ali šibke. Moč kisline daje njena konstanta disociacije.
Dušikova kislina HNO3 je močna kislina ker se v vodni raztopini popolnoma ionizira v protone in nitratne ione:

To pomeni, da ko dodamo HNO3 v vodi bomo pri analizi vode našli le H+ in nitratnih ionov in praktično brez HNO3.
Namesto tega je ocetna kislina v kisu a šibka kislina, ker je ločen le njen del:
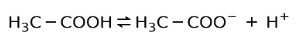
Zato je predstavljen s puščicama v dveh smereh, to pomeni, da bomo imeli v vodni raztopini ocetno kislino, H+ in acetatni anion (H3C-COO-).
Stanja snovi v kislinah
Kisline najdemo v tekočem, trdnem ali plinastem stanju. Na primer, klorovodikova kislina HCl je tekoča, vodikov sulfid HS je plin in oksalna kislina je trdna snov.
Reakcija z lakmusovim papirjem iz kislin

Ko v kislo snov položimo trak lakmusovega papirja, lakmusov papir postane rdeč.
Identifikacija kislin po pH
PH je merilo količine H+ prisoten v raztopini. Tako smo med pH 0 in 7 prisotni kisline. Na primer, kis ima pH enak 2, pH žveplove kisline v avtomobilskih akumulatorjih je enak 1.
Električna prevodnost kislin
Ker lahko kisline disociirajo in tvorijo električno nabite ione, lahko kisle raztopine prevajajo elektriko. Na primer, v avtomobilskih akumulatorjih se žveplova kislina, ki je močna kislina, uporablja kot prevodnik električne energije.
Jedko delovanje močnih kislin
Močne kisline delujejo jedko, lahko zažgejo organska tkiva, zato mora biti ravnanje z njimi zelo previdno.
Šibke kisline tvorijo konjugiran dvojnik
Šibke kisline, ko se raztopijo, tvorijo tako imenovani konjugirani par, to je šibka kislina, ki tvori konjugirano bazo.
Na primer:

V tem primeru mravljična ali metanojska kislina (HCOOH), ko se disociira, tvori konjugirani osnovni ionski format.
Morda vas bo zanimalo:
- Močne in šibke kisline in baze.
- Primeri kislin in baz.
Značilnosti podlag
Nato predstavimo lastnosti osnov ali alkalnih raztopin, ki jih zaznamujejo.
Osnovna ionizacijska zmogljivost
Za osnovne ali alkalne snovi je značilno, da tvorijo ione, ko se raztopijo v vodi:

V tem primeru natrijev hidroksid NaOH ionizira in tvori hidroksidni anion OH- in natrijev kation Na+.
Osnova reagira s kislino in tvori sol
Osnova reagira s kislino v nevtralizacijski reakciji in tvori vodo in sol, na primer:

V tem primeru je aluminijev hidroksid Al (OH)3, baza, reagira s HCl in tvori sol aluminijevega klorida AlCl3 in vodo. Aluminijev hidroksid se uporablja kot antacid za lajšanje želodčnega refluksa z nevtralizacijo kisline, ki jo proizvaja želodec.
Temelji na topnosti v vodi
Nekatere baze so topne v vodi. Zemeljskoalkalijski hidroksidi, kot sta kalcijev hidroksid in barijev hidroksid, so v vodi slabo topni. Na primer, natrijev hidroksid ali kavstično sodo lahko raztopimo 109 g v 100 ml vode pri 20 ° C. Medtem ko magnezijev hidroksid ali magnezijevo mleko Mg (OH)2 v vodi je skoraj netopen.
Osnovna trdnost
Odvisno od stopnje ionizacije baze so te lahko močne ali šibke. Na primer, litijev hidroksid je močna podlaga ker se v vodni raztopini popolnoma ionizira v hidroksidne ione OH in litijeve katione Li+:
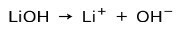
Po drugi strani pa amonijak NH3 je šibka baza kajti ko pride v stik z vodo, amoniak ne disociira:
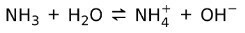
Stanje zadev baz
Baze najdemo v trdnem, tekočem in plinastem stanju. Na primer, čisti natrijev hidroksid je trden, amonijak je plin.
Reakcija z lakmusovim papirjem podstavkov
Ko trak lakmusovega papirja položimo v alkalno snov, papir postane modre barve.
Identifikacija baz po pH
Za baze je značilno, da imajo pH med 7 in 14.
 Električna prevodnost podstavkov
Električna prevodnost podstavkov
Osnove zaradi svoje ionizacijske zmogljivosti so dobri prevodniki električne energije. Na primer, v alkalnih baterijah se kalijev hidroksid KOH uporablja kot električni vodnik.
Jedko delovanje baz
Močne baze lahko poškodujejo organska tkiva. Na primer, čistila za kuhinjske pečice so na splošno močna podlaga in z njimi je vedno priporočljivo ravnati zelo previdno, nositi rokavice in zaščito za oči.
Šibke osnove tvorijo konjugirani dvojnik
Šibke baze, ko se raztopijo, tvorijo konjugirano dvojico, to je šibka baza, tvori konjugirano kislino.
Na primer, tris- (hidroksimetil) amino metan (OHCH2)3CNH2 je šibka baza, katere konjugirana kislina je (OHCH2)3CNH3+:
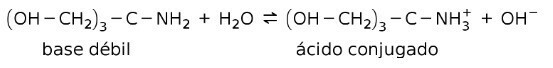
To je osnova za delovanje puferskih snovi oz medpomnilnik, ki so snovi, ki se uporabljajo za stalno vzdrževanje pH raztopin.
Morda vas zanima, kakšne so razlike med:
- Kisline in baze.
- Kationi in anioni



