МОЛЕКУЛАРНА геометрија: дефиниција и примери
Тхе тродимензионални облик у коме су распоређени атоми који чине молекул познат је под именом молекуларна геометрија или молекуларна структура.
Из теоријског модела могуће је закључити геометрију ових молекула: модел одбијања парова електрона у валентној љусци (РПЕЦВ). Овај модел је посебно користан за представљање геометрије молекула састављених од малих атома и повезаних ковалентним везама (дељење електрона).
У овој лекцији од УЧИТЕЉА открићемо дефиниција молекуларне геометрије и примери Тако да на овај начин можете научити од чега се састоји РПЕЦВ модел, како се овом методом и неким примерима може утврдити геометрија молекула.
Индекс
- Дефиниција молекуларне геометрије
- Примери молекуларне геометрије
- Познајте Луисову структуру молекула
- Модел одбијања електронских пара валентне љуске (РПЕЦВ)
Дефиниција молекуларне геометрије.
Молекуларна геометрија или молекуларна структура је начин атома нашао молекул распоређени су у простору.
Ова тродимензионална структура (молекуларна геометрија) долази
дефинисан низом сила који атоме држе заједно у одређеном распореду. Међу силама које одређују молекуларну геометрију најважније су везе да је атома положити једни другима да формирају молекул.Геометрија молекула је веома важна јер одређује које су физичкохемијске карактеристике материје. На пример: молекули Х2О имају угаону геометрију која је дата везама које га чине. Усвајање ове геометрије под углом чини молекул воде електричним диполом и има изузетна својства. Захваљујући својој геометрији, вода је течна на собној температури, способна је да раствори многе супстанце итд.
Очигледно, с обзиром на величину молекула, њихова геометрија се не може посматрати директно и мора се утврдити посредним методама. Даље, неопходно је представити ове геометрије помоћу теоријских модела.
Ови теоријски модели омогућавају нам да утврдимо каква је геометрија молекула из његове молекуларне формуле.
Примери молекуларне геометрије.
Као што смо видели у претходном одељку, атоми који чине молекул могу стећи различите просторне аранжмане (геометрије). У овом одељку видећемо неке примере молекуларне геометрије.
Дводимензионалне геометрије
У неким случајевима молекули добијају равне или дводимензионалне геометрије, односно то су структуре које имају само две димензије и заузимају површину (немају запремину).
Линеарна геометрија
То је најједноставнија геометрија, ради се о молекулима чији су атоми спојени у равну линију. Сви молекули састављени од два атома су линеарни, али ова геометрија се јавља и код молекула који се састоје од три атома.
Примери линеарних молекула:
Настају од два атома: сви двоатомни гасови као што су О2, Х2.
Састоји се од три атома: ЦО2 (угљен-диоксид).
Угаона геометрија
Они су молекули састављени од три атома који се спајају под углом. Амплитуда насталог угла може бити различита, у зависности од врсте атома који га чине. Амплитуде углова које формирају угаони молекули имају вредности између 90º и 120º.
Примери: Х2О, СО2 (сумпор-диоксид), СнЦл2 (калај-дихлорид)
Троугласта геометрија
Они су молекули састављени од четири атома, с једним атомом који се налази у центру замишљеног троугла, а остала три преостала атома налазе се у сваком од врхова овог троугла.
Примери: СО3 (сумпор-триоксид), НО3- (нитратни јон)
Квадратна геометрија
Молекули са овом геометријом имају 5 атома. Један се налази у центру квадрата, а други 4 у сваком од врхова слике.
Примери: КсеФ4 (ксенонски трифлуорид)
Тродимензионалне геометрије
Имају три димензије, односно имају запремину. Геометрија 3Д молекула је веома разнолика, овде ћемо видети само неколико примера.
Тетраедарска геометрија
Ову геометрију представљају неки молекули формирани од пет атома, у њој се налази атом средиште замишљене коцке и четири преостала атома налазе се на теменима коцке (тетраедар).
Пример: ЦХ4 (метан), МнО4-(перманганатни јон)
Тригонална пирамидална геометрија
Они су молекули са четири атома распоређених у четири темена пирамиде са троугластом основом.
Пример: НХ3 (амонијак), ПХ3 (фосфин)
Четвороугаона пирамидална геометрија
У овом случају број атома који чине молекул је шест, а пет их је поређаних у темена пирамиде са квадратном основом, док шеста заузима средиште квадрата база.
Пример: ЦлФ5 (хлор пентафлуорид)
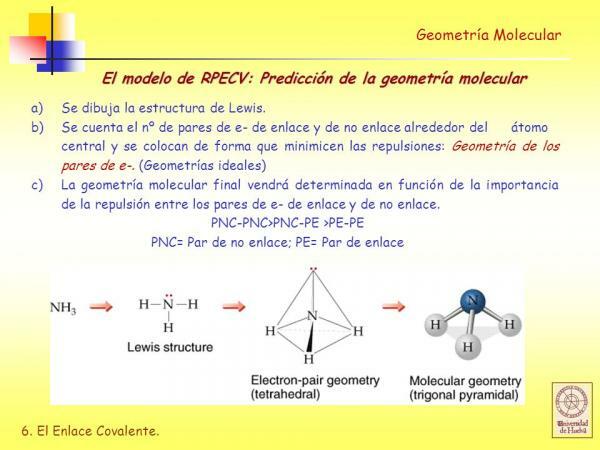
Познајте Луисову структуру молекула.
Пре него што почнете да користите РПЕЦВ метода потребно је знати шта је то Левисова структура молекула и за ово прво морате знати шта је електронска конфигурацијаиз слоја Валенсије различитих атома који чине молекул.
Стога, пре него што одредимо геометрију молекула, потребно је извршити неке претходне кораке:
- ДО. Добити електронске конфигурације различитих атома који чине молекул.
- Б. Одредити број електрона валентне љуске сваког од атома. Електрони у валентној љусци су електрони које атом може користити за стварање веза.
- Ц. Изведите Левисову структуру узимајући у обзир колико електрона има сваки атом у својој валентној љусци.
Слика: Слидеплаиер
Модел одбијања електронских пара валентне љуске (РПЕЦВ)
У Левисове структуре сваки од везаних атома мора да испуњава правило октета. Када атом испуни правило октета, окружен је са четири пара електрона који могу бити електрони који су део веза (везујући електронски парови) или електронски парови који не учествују у стварању веза (невезујући електронски парови) везивање).
Као што ћемо видети, једном утврдите Левисову структуру молекула, изведите његову геометрија која користи модел одбијања електронских парова валентне љуске је врло лако.
Према овом моделу представљања, лиганди (Кс) и невезујући електронски парови (Е) распоређени су око централног атома (А), тако да је растојање између њих максимално. Збир лиганда и невезујућих електронских парова (Кс + Е) одређује врсту геометрије молекула.
Кс + Е = 2
Линеарна геометрија
АКС2: Молекул који чине два атома лиганда везана за централни атом
Пример: берилијум-хидрид (БеХ2).
Кс + Е = 3
Троугласта геометрија равни (једнакостранични троугао)
АКС3: Молекул који се састоји од три атома везана за централни атом
Примери: Неки хлориди попут бора или алуминијума (БЦл3, АлЦл3)
Угаона геометрија (угао 120º)
АКС2Е: Молекул са централним атомом везаним за два лиганда и невезујућим електронским паром.
Примери: калај (ИИ) хлорид (Сн2Цл)
Кс + Е = 4
Тетраедарска геометрија
АКС4: Молекули са централним атомом са четири лиганда распоређених у везе тако да су лиганди имају на врховима супротних дијагонала коцку чије је средиште сам централни атом.
Примери: Молекули као што су метан (ЦХ4), силицијум хлорид (СиЦл4) или угљен тетрахлорид (ЦЦл4) представљају ову геометрију.
Тригонална пирамидална геометрија
АКС3Е: Молекули са 3 лиганда и 1 усамљеним електронским паром у којем су атоми три лиганда распоређени да формирају основа пирамиде са троугластом основом у којој је централни атом у горњем вертексу реченог пирамида
Примери: један од молекула који има ову геометрију је амонијак (НХ3).
Угаона геометрија (угао 109º)
АКС2Е2: Два лиганда и централни атом распоређени су тако да формирају угао од 109º
Примери: Вода (Х2О) је један од молекула који имају ову геометрију.
Г.линеарна еометрија
АКС3: Пошто је за централни атом везан само један лиганд, геометрија је линеарна.
Пример: Водоник-флуорид или флуороводонична киселина (ХФ).
Кс + Е = 5
Тригонална бипирамидална геометрија
АКС5: Молекул има геометрију две супротстављене пирамиде, са троугластом основом заједничком обема. Централни атом је распоређен у центру, а лиганди се налазе на теменима.
Пример: Фосфор пентахлорид (ПЦл5)
Дисхеноидална геометрија
АКС4Е: У овој врсти геометрије, атоми добијају распоред који подсећа на структуру клацкалице.
Пример: Тетра сумпор флуорид (СФ4).
Т геометрија
АКС3Е2: Молекули су обликовани попут слова Т, са лигандима на крајевима слова и централним атомом на месту где се две линије које га чине састају.
Пример: Хлор трифлуорид (ЦлФ3)
Линеарна геометрија
АКС2Е3: У овом случају, три атома молекула су распоређена у равни са централним атомом у средњем положају.
Пример: Ксенон дифлуорид (Ф2Ксе)
Кс + Е = 6
Октаедарска геометрија
АКС6: Ова врста молекула има структуру која подсећа на октаедар у коме би централни атом заузимао средиште геометријске фигуре и шест лиганда у сваком од њених врхова.
Пример: Сумпор хексафлуорид (СФ6)
Пирамида квадратне основе
АКС5Е: У овом случају, атоми чине фигуру у којој централни атом заузима средиште базе, а лиганди пет врхова фигуре.
Пример: бромов пентафлуорид (БрФ5)
Равна квадратна геометрија
АКС4Е2: Атоми добијају распоред квадратног облика, у којем централни атом заузима средиште фигуре, а лиганди сваки од његових темена.
Пример: Ксенон тетрафлуорид-јон (КсеФ4)

Ако желите да прочитате још чланака сличних Молекуларна геометрија: дефиниција и примери, препоручујемо вам да уђете у нашу категорију Атом.
Библиографија
Алејандрина Галлего Пицо, Роса Мª Гарцинуно Мартинез, Мª Јосе Морцилло Ортега, Мигуел Ангел Вазкуез Сегура. (2018) Основне хемије. Мадрид: Унед
