Разлика између јаких и слабих киселина и база (са примерима)
Класификација киселина и база у хемији зависи од силе јонизације ових супстанци у воденом медијуму. А) Да:
- а киселина и база су јаки када су потпуно јонизовани, односно у процесу јонизације потпуно се трансформишу у катионе или позитивне јоне и у ањоне или негативне јоне.
- С друге стране, киселина и база су слабе када су делимично јонизовани у води, односно у раствору, биће пропорција катионова, друга пропорција ањона и друга пропорција недисоцираних молекула.
| Јаке киселине и базе | Слабе киселине и базе | |
|---|---|---|
| Дефиниција | Супстанце које се потпуно јонизују у раствору. | Супстанце које се делимично јонизују у раствору. |
| Јонизација | комплетан | Делимично |
| Елементи у воденом раствору | Катиони и аниони у истој концентрацији. | Катион, аниони и молекули у различитим пропорцијама. |
| Константа јонизације | Повишен | Мало |
| Примери |
|
|
Јаке киселине и базе
А. киселина или база су јаки када се у воденом медијуму потпуно дисоцирајуДругим речима, поступак јонизације је завршен и решење ће садржати исту концентрацију ањона и катиона.
Како јонизујете киселину и јаку базу?
Јака киселина, попут хлороводоничне киселине ХЦл, јонизује се на следеће начине:
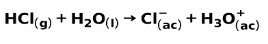
Јака база, као што је натријум хидроксид НаОХ, јонизује на следеће начине:
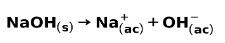
Примери јаких киселина и њихове формуле
| Јаке киселине | Формула |
|---|---|
| Хлороводонична киселина | ХЦл |
| Сумпорна киселина | Х.2СВ4 |
| Азотна киселина | ХНО3 |
| Бромоводична киселина | ХБр |
| Перхлорна киселина | ХЦлО4 |
| Хромна киселина | Х.2ЦрО4 |
| Тетрафлуроборна киселина | ХБФ4 |
Примери јаких основа и њихове формуле
| Јака база | Формула |
|---|---|
| Натријум хидроксид | НаОХ |
| Литијум хидроксид | ЛиОХ |
| Калијум хидроксид | КОХ |
| Рубидијум хидроксид | РбОХ |
| Цезијум хидроксид | ЦсОХ |
| Калцијум хидроксид | Ца (ОХ)2 |
| Баријум хидроксид | Ба (ОХ)2 |
| Стронцијум хидроксид | Ср (ОХ)2 |
| Алуминијум хидроксид | Ал (ОХ)3 |
Можда ће вас занимати више примери киселина и база.
Слабе киселине и базе
А. Киселина или база су слабе када су делимично јонизоване у воденом раствору, односно у раствору се налазе јони и нејонизовани молекули.
Како јонизујете киселину и слабу базу?
Слаба киселина, као што је сирћетна киселина ЦХ3ЦООХ, јонизује се на следећи начин:
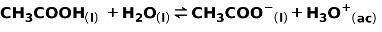
Равнотежа ове реакције изражена је двема стрелицама у супротним смеровима.
Када се слаба киселина дисоцира или јонизује, успоставља се равнотежа између врста присутних у раствору; ово се може изразити а константа јонизацијекисело:
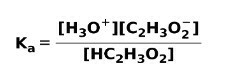
Константа јонизације није ништа друго до однос између умножавања концентрације производа над умножавањем концентрације реактаната.
Слаба база, као што је НХ амонијак3, јонизује се на следећи начин:
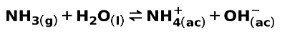
Када се слаба база дисоцира или јонизује, успоставља се равнотежа између врста присутних у раствору; ово се може изразити а основна константа јонизације:
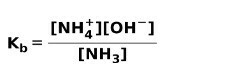
Можда ће вас занимати разлика између Киселине и базе.
Примери слабих киселина са њиховом формулом и константом јонизације киселине К.до
| Слаба киселина | Формула | Константа јонизације |
|---|---|---|
| Мравља киселина | Х.2ЦО2 | 1,77 к 10-4 |
| Сирћетна киселина | Х.3ЦЦОХ | 1,75 к 10-5 |
| Цијановодонична киселина | ХОЦН | 3,30 к 10-4 |
| Водоник цијанид | ХЦН | 6,20 к 10-10 |
| Хлороводонична киселина | ХОЦл | 3,50 к 10-8 |
| Азотна киселина | ХНО2 | 4,00 к 10-4 |
| Млечна киселина | ХЦ3Х.5ИЛИ3 | 1,40 к 10-4 |
| Угљена киселина | Х.2ЦО3 |
4,30 к 10-7 5,60 к 10-11 |
| Борна киселина | Х.3БО3 |
5,80 к 10-10 1,80 к 10-13 3,00 к 10-14 |
Примери слабих база са њиховом формулом и основном константом јонизације К.б
| Слаба основа | Формула | Константа јонизације |
|---|---|---|
| Амонијак | НХ3 | 1,75 к 10-5 |
| Метиламин | ЦХ3НХ2 | 4,38 к 10-4 |
| Етиламин | Ц.2Х.5НХ2 | 5,60 к 10-4 |
| Анилин | Ц.6Х.5НХ2 | 3,80 к 10-10 |
| Пиридин | Ц.5Х.5Н. | 1,70 к 10-9 |
| Бензиламин | Ц.7Х.9Н. | 2,20 к 10-5 |
| Натријум бикарбоната | НаХЦО | 2,00 к 10-4 |
Можда ће вас занимати више о томе Карактеристике киселина и база