10 врста хемијских елемената (објашњено и класификовано)
Колико хемијских елемената мора постојати у свемиру? Ово питање још има дуг пут, јер научници с времена на време стварају сопствене вештачке хемијске елементе.
Међутим, оно на шта можемо одговорити је колико врста хемијских елемената мора постојати, нешто што ћемо следеће сазнати.
- Везани чланак: "11 врста хемијских реакција"
Врсте хемијских елемената
У природи можемо пронаћи све врсте супстанци. Ове супстанце се обично не налазе у чистом стању, већ су резултат комбинације различитих елемената или материјала који су кроз различите реакције, процесе и временске периоде изазвали све врсте материја. Не постоји ништа у свемиру што није резултат комбинације атома који припадају различитим врстама хемијских елемената, што ћемо детаљно видети.
Међутим, пре него што погледамо врсте хемијских елемената, направимо мали преглед средњошколских наука и сетимо се шта су хемијски елементи.
Матику „хемијски елемент“ називамо материјом која се састоји од исте врсте атома, односно супстанце која је атомски чиста.
Хемијски елементи се не могу разложити на једноставније и класификовани су у периодном систему елемената као чисти материјали универзума.Али опрез! Не смемо мешати елементе са једноставним супстанцама, јер се у одређеним случајевима могу састојати два или више атома истог елемента молекули груписани на различите начине због којих се разликују нека од физичких својстава дотичног елемента, а ти случајеви су изотопи. На пример, дијамант и угљеник су супстанце направљене од хемијског елемента угљеника (Ц). али то је организовано на различите начине и резултира у два потпуно различита материјала.
Царл саган Рекао је да смо звездана прашина која се одражава на звезде. Ова лепа фраза није пука метафора, већ научна чињеница. Хемијски елементи настају, колико знамо, унутар звезда као резултат комплекса фузије и процеси атомске фисије који стварају све теже елементе, резултат процеса тзв нуклеосинтеза.
Већина познатих елемената може се добити из природе, пронађени спонтано или формирајући једињења са другим елементима као што су уранијум (У), угљеник (Ц), силицијум (Си), сребро (Аг) или злато (Ау). Други су, с друге стране, произведени у лабораторијама као што су америциум (Ам), беркелиум (Бк) или куриум (Цм). Какав год био начин његовог добијања или ако је присутан у природи, у зависности од његових својстава, дотични хемијски елемент ће имати неку или другу употребу.
Тренутно је познато око 118 хемијских елемената, мада је, узимајући у обзир да су људи били у стању да произведу нове елементе, питање времена када ће се периодни систем проширити.
- Можда ће вас занимати: "2 врсте електричне енергије (објашњено)"
Главне врсте хемијских елемената
Главни типови хемијских елемената представљени су у периодном систему, систему класификацију коју је створио руски хемичар Дмитриј Мендељејев (1834-1907) који је поставио темеље у 1869. Хемијски елементи су визуелно поређани на основу њихових својстава и карактеристика.
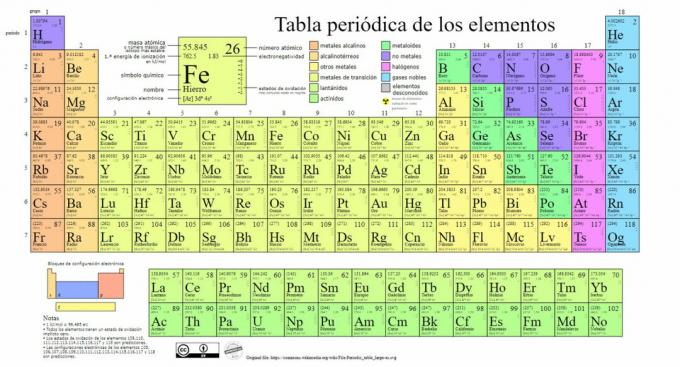
Како је време пролазило и како је хемија чинила важна научна открића, ова табела ће се узастопно проширивати, достигавши данашњи облик са до сада познатих 118 елемената.
Тренутно у овој табели можемо пронаћи следеће врсте хемијских елемената:
1. Метали
Метали су хемијски елементи који генерално садрже између једног и три електрона у последњој орбити свог атома, електрони који се лако могу пренети чинећи их проводницима топлоте и електричне енергије.
Метали су обично савитљиви и дуктилни, карактеристичног сјаја чији интензитет зависи од кретања електрона који чине њихове атоме. Углавном су метали чврсти на собној температури, осим живе.
Међу металима налазимо злато (Ау), сребро (Аг), бакар (Цу) и алуминијум (Ал) чије физичке карактеристике их чине величанственим проводницима електричне енергије, иако је њихово присуство у природи врло разнолико, што се огледа у разлици између њихових тежина.
Верује се да 75% хемијских елемената који постоје у природи чине метали, док би преосталих 25% чинили племенити гасови, металоиди и друге врсте.
У оквиру ове категорије постоје класификације, у којима се налазе актиниди, лантаниди, прелазни метали, алкални метали, земноалкални метали и други метали.
- Везани чланак: „10 намирница богатих цинком“
1.1. Лантаниди
Елементи лантанида налазе се у наслагама које чине многи минерали. То су бели метали који лако оксидирају у додиру са ваздухом. Међу њима налазимо лантан (Ла), прометијум (Пм), европијум (Еу) и итербијум (Иб).

- Можда ће вас занимати: "5 врста хемијских веза: овако је састављена материја"
1.2. Ацтинидес
Сви изотопи актинида су радиоактивни. Међу њима налазимо актинијум (Ац), уранијум (У), плутонијум (Пу) и еинстеинијум (Ес).
1.3. Прелазних метала
Прелазни метали се налазе у централном делу периодичног система. Његова главна карактеристика је то имају електронску конфигурацију "д" орбите делимично испуњену електронима.
У овој групи има супстанци свих врста и, према најширој класификацији, одговарале би хемијским елементима од 21 до 30, од 39 до 48, од 71 до 80 и од 103 до 112, што је укупно четрдесет и међу њима бисмо нашли ванадијум (В), рутенијум (Ру), сребро (Аг), тантал (Та) и Лавренцио (Лр).

1.4. Алкални метали
Алкални метали су група од шест елемената састављених од литијума (Ли), натријума (На), калијума (К), рубидијума (Рб), цезијума (Цс) и францијума (Фр). Они су сјајни, меки метали, високо реактивни на нормалној температури и притиску и лако губе спољни електрон, који се налази у њиховој "с" орбити.
1.5. Алкалне земље
Земноалкални метали су група елемената у којима налазимо берилијум (Бе), магнезијум (Мг), калцијум (Ца), стронцијум (Ср), баријум (Ба) и радијум (Ра). Његово име потиче од назива оксида, "земље", који имају основна или алкална својства.
Алкалне земље тврђи су од алкалних, сјаје и добри су електрични проводници. Они су мање реактивни од алкалних и делују као добри редукциони агенси. Имају способност стварања јонских једињења и сви имају два електрона у својој најудаљенијој љусци.

1.6. Остали метали
Категорија "остали метали" је врста супстанци које се овде налазе јер заиста не знате где да их ставите.
Они су метални елементи који се налазе у периодном систему заједно са металоидима, унутар п блока. Обично су мекани са ниским тачкама топљења. Међу њима су алуминијум (Ал), индијум (Ин), калај (Сн) и бизмут (Би).

2. Без метала
Неметали генерално поседују између пет и седам електрона у својој последњој орбити, што је својство које чини да добијају електроне уместо да их се одрекну и на тај начин успевају да имају осам електрона који их на тај начин стабилизују атоми.
Ови елементи они су веома лоши проводници топлоте и електричне енергије. Уз то, немају карактеристичан сјај, нису јако савитљиве, нису јако дуктилне и врло су крхке у чврстом стању. Не могу се ваљати или растезати, за разлику од метала.
Они су углавном неопходни за биолошке системе, јер су присутни у органска једињења, као што су сумпор (С), угљеник (Ц), кисеоник (О), водоник (Х) и јод (И).

- Везани чланак: "20 врста драгог камења (описано и са сликама)"
3. Металоиди
Као што им име говори, металоиди су средња класификација између метала и неметала који имају својства обе групе. То је због чињенице да у последњој орбити имају четири атома, што је средња количина у односу на ону метала и неметала.
Ови хемијски елементи проводе електричну струју само у једном смеру, не дозвољавајући да се она одвија у супротном смеру као у металима. Пример за ово налази се у силицијуму (Си), металоиду који се користи у производњи полупроводничких елемената за електронску индустрију захваљујући овом својству.
Остали металоиди су: бор (Б), арсен (Ас), антимон (Сб) и полонијум (По).

4. Халогени
Халогени су група од шест елемената који склони су да формирају молекуле састављене од два атома (двоатомних) који су због своје електронегативности веома хемијски активни.
Ове супстанце се обично појављују у облику јона, односно електрично наелектрисаних молекула, који су у овом случају мононегативни, високо оксидирајући. То значи да су халогени каустичне и корозивне супстанце.
Халогени су: флуор (Ф), хлор (Цл), бром (Бр), јод (И), астат (Ат) и тенез (Тс).

5. племените гасове
Племенити гасови су група од седам чије је природно стање гасовито. Обично се појављују у облику двоатомних молекула врло ниске реактивности, односно не реагују са другим елементима који сачињавају друге супстанце и из истог разлога су познати као инертни гасови. То је зато што у последњој орбити постоји највећи могући број електрона за тај ниво, укупно осам.
Ова одабрана група елемената састоји се од хелијума (Хе), неона (Не), аргона (Ар), криптона (Кр), ксенона (Ксе), радона (Рн) и оганесона (Ог), раније познатог као унуноцтиум.
