ตารางธาตุมีไว้เพื่ออะไร?
ตารางธาตุเป็นระบบการจำแนกองค์ประกอบอะตอมที่คิดค้นในปี พ.ศ. 2412 โดยนักเคมีชาวรัสเซีย Russian Dmitri Mendeleev และต่อมาได้จัดระบบและปรับปรุงใหม่โดยนักเคมีคนอื่น ๆ จนกระทั่งถึงรูปลักษณ์ของเขา ปัจจุบัน. แม้จะเป็นเครื่องมือที่ได้รับการพิสูจน์แล้วว่ามีประโยชน์ตลอดประวัติศาสตร์ (นั่นคือเหตุผลที่ยังคงใช้และปรับปรุงต่อไป) มันคือ น่าเบื่อหน่ายในการเรียนรู้และทำความเข้าใจ นั่นคือเหตุผลที่เราทุกคนต่างตั้งคำถามกับตัวเองว่า "โต๊ะมีไว้เพื่ออะไร? เป็นระยะ? ".
ถ้าอยากรู้ ตารางธาตุสำหรับ .คืออะไร และเหตุใดจึงสำคัญที่ต้องเข้าใจคุณสมบัติของมัน อ่านบทเรียนนี้ต่อจากครูผู้สอน
ดัชนี
- การจำแนกตารางธาตุ
- การหาชื่อหรือสัญลักษณ์ของธาตุด้วยตารางธาตุ
- รู้มวลอะตอมของธาตุ
- รู้เลขอะตอมของธาตุ
- ทำนายรัศมีอะตอมของธาตุ
- เปรียบเทียบพลังงานไอออไนเซชันของธาตุทั้งสอง
- การหาอิเล็กโตรเนกาติวีตี้ขององค์ประกอบทางเคมี
- เปรียบเทียบความสัมพันธ์ของอิเล็กตรอนของสององค์ประกอบ
การจำแนกตารางธาตุ
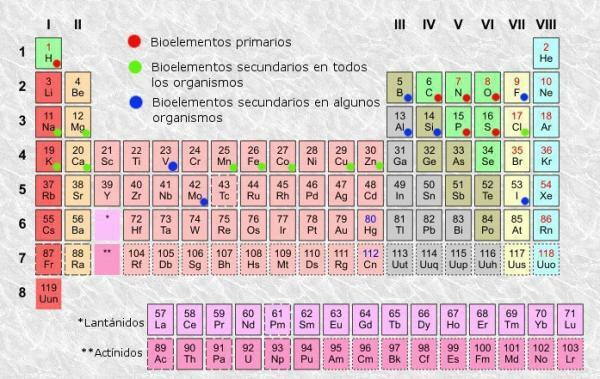
เช่นเดียวกับในตารางใดๆ ใน ตารางธาตุ ขององค์ประกอบ เราสามารถแยกแยะคอลัมน์ (แนวตั้ง) และแถว (แนวนอน) ในตารางธาตุมี 18 คอลัมน์หรือกลุ่มและ 7 แถวหรือจุด
นอกจากนี้ คุณจะสามารถยืนยันได้ว่าโดยปกติภายในแต่ละช่องในตาราง อย่างน้อยก็มีข้อมูลต่อไปนี้ปรากฏขึ้น:
- สัญลักษณ์องค์ประกอบทางเคมี: ตัวย่อหรือสัญลักษณ์ที่ใช้ในการระบุองค์ประกอบ โดยปกติแล้วจะประกอบด้วยตัวอักษรหนึ่งหรือสองตัว โดยตัวแรกจะเป็นตัวพิมพ์ใหญ่เสมอ
- ชื่อองค์ประกอบทางเคมี: ชื่อขององค์ประกอบทางเคมีที่ตรงกับตัวย่อด้านบน มักจะอยู่ใต้สัญลักษณ์
- เลขอะตอม: จำนวนโปรตอนทั้งหมดที่แต่ละอะตอมของธาตุนั้นมี โดยปกติจะปรากฏที่ด้านบนซ้ายของกล่องรายการ (หรือที่ด้านบนขวาของตารางที่สมบูรณ์กว่า)
- มวลอะตอม: โดยปกติมวลของอะตอมถือได้ว่าเป็นมวลรวมของโปรตอนและนิวตรอนในอะตอมเดียว ซึ่งอยู่ใต้ชื่อขององค์ประกอบในตารางที่ง่ายที่สุด แม้ว่าในตารางอื่นๆ อาจปรากฏที่ส่วนบนขวาของกล่ององค์ประกอบ
มีตารางธาตุที่มีข้อมูลที่ซับซ้อนและเฉพาะเจาะจงอื่นๆ เช่น สถานะออกซิเดชัน (มีประโยชน์ในการกำหนดสารประกอบทางเคมี เป็นต้น) พลังงานไอออไนซ์ อิเล็กโตรเนกาติวีตี้ เป็นต้น แต่ตารางธาตุพื้นฐานมักจะ ให้ข้อมูลที่เพียงพอและมักจะเพียงพอสำหรับผู้ใช้ทั่วไป ซึ่งสามารถค้นหาข้อมูลดังที่เราบอกคุณด้านล่าง

ค้นหาชื่อหรือสัญลักษณ์ขององค์ประกอบด้วยตารางธาตุ
บางครั้งเราก็รู้ว่า สัญลักษณ์องค์ประกอบทางเคมี แต่เราไม่รู้จักชื่อของเขา ในบางครั้ง เราก็รู้ว่า ชื่อองค์ประกอบทางเคมีแต่ไม่ใช่ตัวย่อหรือสัญลักษณ์ อันที่จริง มันง่ายมากที่สิ่งนี้เคยเกิดขึ้นกับคุณในชั้นเรียน
ในกรณีเหล่านี้ เราสามารถใช้ตารางธาตุโดยไม่จำเป็นต้องเป็นตารางที่ซับซ้อน และพิจารณาข้อมูลที่ขาดหายไปอย่างรวดเร็วและแม่นยำ
รู้มวลอะตอมของธาตุ.
บางครั้งเรารู้องค์ประกอบทางเคมีที่เรากำลังเผชิญอยู่ แต่เราจำเป็นต้องรู้ มวลอะตอมนั่นคืออะตอมของธาตุนั้นมีน้ำหนักเท่าใด
ข้อมูลนี้จะเป็นประโยชน์ ตัวอย่างเช่น เมื่อทำงานต่อไปนี้:
- คำนวณปริมาณเฉพาะของสาร
- วิเคราะห์ผลลัพธ์ที่ได้จากการทดสอบหรือการทดลอง
- คำนวณเปอร์เซ็นต์ของมวล
- ทำความเข้าใจมวลโมลาร์ที่แม่นยำของโมเลกุลที่ซับซ้อน
รู้เลขอะตอมของธาตุ.
เลขอะตอมคือ จำนวนโปรตอนทั้งหมดที่อะตอมของธาตุมี. ในอะตอมที่เป็นกลางทางไฟฟ้า นอกเหนือจากไอออนบวก (มีประจุบวก โดยมีอิเล็กตรอนน้อยกว่าสถานะปกติหนึ่งตัว) หรือประจุลบ (มีประจุลบ มีอิเล็กตรอนมากกว่าสถานะปกติ 1 ตัว) จำนวนโปรตอนจะเท่ากับ อิเล็กตรอน
จำนวนโปรตอนเป็นปัจจัยในการตัดสินใจเมื่อต้องแยกแยะองค์ประกอบหนึ่งจากอีกองค์ประกอบหนึ่ง เนื่องจากจำนวนอิเล็กตรอนหรือนิวตรอนไม่ได้เปลี่ยนประเภทขององค์ประกอบ

ทำนายรัศมีอะตอมของธาตุ
รัศมีอะตอมมีระยะห่างเพียงครึ่งเดียวระหว่างจุดศูนย์กลางของอะตอมสองอะตอมของธาตุเดียวกันซึ่งแทบจะไม่สัมผัสกัน ในกรณีนี้ ให้รู้ว่า ตำแหน่งขององค์ประกอบทางเคมีในตารางธาตุ สามารถช่วยเราหารัศมีอะตอมโดยประมาณหรือเปรียบเทียบกับธาตุอื่นได้ เพื่อการนี้เราต้องรู้เอาไว้ว่า รัศมีอะตอม:
- จะเพิ่มขึ้นเมื่อเราเคลื่อนจากบนลงล่างของตารางธาตุ
- มันลงมาเมื่อเราเลื่อนจากซ้ายไปขวาผ่านตารางธาตุ
ด้วยวิธีนี้ แคลเซียมจึงมีขนาดเล็กกว่ารูบิเดียมแต่ใหญ่กว่าธาตุเหล็ก
เรียนรู้เพิ่มเติมเกี่ยวกับ รัศมีอะตอมคืออะไร กับบทเรียนวิดีโออื่นๆ จากครู
เปรียบเทียบพลังงานไอออไนเซชันของธาตุทั้งสอง
พลังงานไอออไนซ์ คือ พลังงานที่จำเป็นในการกำจัดอิเล็กตรอนออกจากอะตอมของธาตุ. ในกรณีนี้ หากเราทราบตำแหน่งของธาตุสองธาตุในตารางธาตุ เราจะรู้ได้ว่าธาตุใดจะ "เอา" อิเล็กตรอนจากธาตุได้ง่ายขึ้น เราจะต้องคำนึงว่า:
- พลังงานไอออไนซ์จะลดลงเมื่อเคลื่อนที่ขึ้นและลงในตารางธาตุ
- พลังงานไอออไนซ์จะเพิ่มขึ้นเมื่อคุณเคลื่อนจากด้านซ้ายไปด้านขวาของตารางธาตุ
ระหว่างเบริลเลียมกับออกซิเจน ออกซิเจนมีพลังงานไอออไนเซชันมากกว่า ถ้าเราเปรียบเทียบออกซิเจนกับกำมะถันซึ่งอยู่ในกลุ่มเดียวกัน แต่ในช่วงถัดไป ออกซิเจนก็มีพลังงานไอออไนเซชันสูงกว่าเช่นกัน เนื่องจากจะสูงกว่าในตารางธาตุ
หาค่าอิเล็กโตรเนกาติวีตี้ของธาตุเคมี.
อิเล็กโตรเนกาติวิตี คือ ความสามารถของอะตอมในการดึงดูดอิเล็กตรอน. ในทางปฏิบัติสิ่งนี้แปลเป็นความสามารถในการสร้างพันธะเคมี หากต้องการทราบว่าองค์ประกอบทางเคมีจะมีความสามารถในการสร้างพันธะเคมีได้ดีหรือไม่ เราต้องพิจารณาเฉพาะรูปแบบที่ตามมาในตารางธาตุเท่านั้น นั่นคือ
- มันลงมาในขณะที่มันเคลื่อนขึ้นและลง
- จะเพิ่มขึ้นเมื่อคุณเลื่อนจากซ้ายไปขวา
เช่นเดียวกับในกรณีก่อนหน้านี้ ออกซิเจนมีอิเล็กโตรเนกาติตีมากกว่าเบริลเลียมและกำมะถัน เนื่องจากอยู่ทางขวามากกว่าตัวแรกและสูงกว่ากำมะถัน

เปรียบเทียบความสัมพันธ์ของอิเล็กตรอนของธาตุทั้งสอง
ความสัมพันธ์ทางอิเล็กทรอนิกส์ เขาคือ การเปลี่ยนแปลงของพลังงานที่อะตอมเป็นกลางเกิดขึ้นเมื่อดึงดูดอิเล็กตรอน ให้กลายเป็นไอออนลบ ในกรณีนี้ ความเกี่ยวข้องทางอิเล็กทรอนิกส์ไม่ได้แตกต่างกันเหมือนกับในกรณีก่อนหน้านี้ แม้ว่าเราสามารถพูดได้ว่าโดยทั่วไปแล้ว ความเกี่ยวข้องทางอิเล็กทรอนิกส์:
- เพิ่มขึ้นในช่วงเวลาเดียวกันจากซ้ายไปขวา
- ขึ้นไปในกลุ่มเดียวกันจากล่างขึ้นบน
หากคุณต้องการอ่านบทความเพิ่มเติมที่คล้ายกับ ตารางธาตุมีไว้เพื่ออะไร?เราขอแนะนำให้คุณป้อนหมวดหมู่ของเรา อะตอม.
อ้างอิง
คุณมีข้อมูลหรือความคิดเห็นเกี่ยวกับการใช้ตารางธาตุหรือไม่? อย่าลังเลที่จะทิ้งไว้ในส่วนความคิดเห็นของเรา! คุณชอบบทความนี้หรือไม่? คุณยังสามารถให้คะแนนของคุณด้านล่าง!