แผนภาพ Moeller: มันคืออะไร, ใช้ในวิชาเคมีอย่างไร, และตัวอย่าง
เคมีอาจซับซ้อนเป็นพิเศษ ดังนั้นจึงยินดีต้อนรับเครื่องมือใด ๆ ที่อำนวยความสะดวกในการเรียนรู้สำหรับผู้ที่ได้รับการแนะนำให้รู้จัก
หนึ่งในวิธีที่นิยมมากที่สุดในการทำความคุ้นเคยกับกฎของมาเดลุงและการกำหนดค่าอิเล็กตรอนของอะตอมคือ แผนภาพ Moeller ซึ่งเป็นกฎช่วยในการจำแบบกราฟิกที่ทำให้ง่ายต่อการดูว่าออร์บิทัลใด อิเล็กตรอน
ต่อไป เราจะค้นพบว่าแผนภาพ Moeller ประกอบด้วยอะไรเกี่ยวข้องกับกฎของมาเดลุงอย่างไร ประยุกต์ใช้กับตัวอย่างที่แก้ไขได้อย่างไร และองค์ประกอบทางเคมีใดที่ไม่ปฏิบัติตามกลยุทธ์นี้
- บทความที่เกี่ยวข้อง: “พันธะเคมี 5 ประเภท สสารมีองค์ประกอบอย่างไร”
แผนภาพ Moeller คืออะไร?
แผนภาพ Moeller หรือที่เรียกว่าวิธีฝนหรือกฎเส้นทแยงมุมคือ วิธีกราฟิกและช่วยในการจำสำหรับการเรียนรู้กฎของมาเดลุง เทคนิคในการรู้และเขียนการกำหนดค่าทางอิเล็กทรอนิกส์ขององค์ประกอบทางเคมี.
แผนภาพนี้มีลักษณะเฉพาะโดยการวาดเส้นทแยงมุมผ่านคอลัมน์ของออร์บิทัลจากบนลงล่างจากขวาไปซ้าย ผ่านไดอะแกรม Moeller ลำดับในการเติมออร์บิทัลถูกกำหนดโดยตัวเลขควอนตัมสามตัว: n, l และ ml
แผนภาพ Moeller ทำงานดังต่อไปนี้:

แต่ละคอลัมน์สอดคล้องกับวงโคจรที่แตกต่างกันซึ่งอิเล็กตรอนของอะตอมหมุนเวียน อนุภาคย่อยของอะตอมที่มีประจุลบ
ออร์บิทัลที่เป็นปัญหาคือ s, p, d และ f ซึ่งแต่ละออร์บิทัลจะมีช่องว่างเฉพาะสำหรับอิเล็กตรอน ดังนั้นระดับพลังงานจึงต่างกัน.หากเราวาดเส้นทแยงมุมหรือลูกศรตามความหมายที่กล่าวข้างต้น เราจะมีออร์บิทัลแรกเป็น 1 วินาที ลูกศรที่สองเริ่มต้นด้วยวงโคจร 2s ลูกศรที่สามข้าม 2p และ 3s เส้นทแยงมุมที่สี่คือ 3p และ 4s เส้นทแยงมุมที่ห้าคือ 3d, 4p และ 5s เป็นต้น แผนภาพ Moeller เป็นเทคนิคเบื้องต้นสำหรับผู้ที่เริ่มศึกษาการกำหนดค่าทางอิเล็กทรอนิกส์ขององค์ประกอบของตารางธาตุในวิชาเคมี
- คุณอาจสนใจ: " 6 สาขาหลักของวิทยาศาสตร์ธรรมชาติ"
กฎของมาเดลุง
ตั้งแต่แผนภาพ Moeller คือการแสดงภาพกฎของมาเดลุง (หรือที่เรียกว่ากฎของ Klechkovsky ในบางประเทศ) ก่อนอื่นเราต้องรู้ว่ามันเกี่ยวกับอะไร ตามกฎนี้ การเติมออร์บิทัลของอะตอมต้องเป็นไปตามกฎสองข้อต่อไปนี้:
กฎข้อแรกของมาเดลุง
ออร์บิทัลที่มีค่าต่ำสุดของ n + l จะถูกเติมก่อน โดยที่ n เป็นเลขควอนตัมหลัก และ l คือโมเมนตัมเชิงมุมของวงโคจร.
ตัวอย่างเช่น ออร์บิทัล 3 มิติสอดคล้องกับ n = 3 และ l = 2 ดังนั้น n + l = 3 + 2 = 5 ในทางกลับกัน 4s ออร์บิทัลสอดคล้องกับ n = 4 และ l = 0 ดังนั้น n + l = 4 + 0 = 4 จากนี้พบว่าอิเล็กตรอนเติม 4s ออร์บิทัลก่อน 3d เพราะ 4s = 4 ในขณะที่ 3d = 5
- บทความที่เกี่ยวข้อง: "ปฏิกิริยาเคมี 11 ชนิด"
กฎข้อที่สองของมาเดลุง
ถ้าออร์บิทัลสองออร์บิทัลมีค่าเท่ากับ n + l อิเล็กตรอนจะเข้ายึดออร์บิทัลที่มีค่า n ต่ำกว่าก่อน.
ตัวอย่างเช่น ออร์บิทัล 3 มิติมีค่า n + l = 5 เหมือนกับออร์บิทัล 4p (4 + 1 = 5) แต่เนื่องจากออร์บิทัล 3 มิติมีค่าต่ำสุดสำหรับ n ออร์บิทัลจึงจะถูกเติมก่อน 4p ออร์บิทัล
จากการสังเกตและกฎเหล่านี้ สามารถบรรลุลำดับต่อไปนี้ในการเติมออร์บิทัลของอะตอม: 1s 2s 2p 3s 3p 4s 3d 4p แม้ว่าคำสั่งนี้จะได้รับการแก้ไขแล้ว แต่การจดจำมันด้วยหัวใจนั้นซับซ้อน ซึ่งเป็นเหตุผลว่าทำไมจึงมีไดอะแกรม Moeller ที่แสดงลำดับแบบกราฟิก
- คุณอาจสนใจ: "หลัก 9 ประการของทฤษฎีอะตอมของดาลตัน"
ขั้นตอนที่ต้องปฏิบัติตามเมื่อใช้แผนภาพ Moeller
ตามที่เราได้แสดงความคิดเห็นไว้ในส่วนก่อนหน้านี้ กฎของมาเดลุงใช้สูตร n + l เพื่อสร้างอะไร ออร์บิทัลจะถูกเติมก่อนและจากที่กำหนดว่าการกำหนดค่าทางอิเล็กทรอนิกส์ขององค์ประกอบคืออะไร มุ่งมั่น. อย่างไรก็ตาม ไดอะแกรม Moeller แสดงสิ่งนี้แบบกราฟิกและง่ายอยู่แล้ว ดังนั้นจึงเพียงพอที่จะปฏิบัติตาม คอลัมน์ของไดอะแกรมเดียวกันและวาดเส้นทแยงมุมเพื่อค้นหาว่าออร์บิทัลของแต่ละออร์บิทัลเป็นอย่างไร ธาตุ.
ในการค้นหาโครงแบบอิเล็กทรอนิกส์ของอะตอมและตำแหน่งของออร์บิทัลของอิเล็กตรอน เราต้องรู้เลขอะตอม Z ก่อน. ตัวเลข Z สอดคล้องกับจำนวนอิเล็กตรอนในอะตอม ตราบใดที่อะตอมนี้เป็นกลางหรือมีค่าเท่ากันว่าไม่ใช่ไอออน ไม่เป็นบวก (ไอออนบวก) หรือลบ (แอนไอออน)
ดังนั้น เมื่อรู้จัก Z สำหรับอะตอมที่เป็นกลาง เราก็รู้แล้วว่าอะตอมที่เป็นกลางของธาตุนั้นมักจะมีอิเล็กตรอนจำนวนเท่าใด เมื่อคำนึงถึงสิ่งนี้ เราจะเริ่มวาดเส้นทแยงมุมบนไดอะแกรม Moeller เราต้องคำนึงว่าออร์บิทัลแต่ละประเภทมีความสามารถต่างกันในการเก็บอิเล็กตรอนซึ่งได้แก่:
- s = 2 อิเล็กตรอน
- p = 6 อิเล็กตรอน
- d = 10 อิเล็กตรอน
- f = 14 อิเล็กตรอน
มันหยุดที่วงโคจรที่มีอิเล็กตรอนตัวสุดท้ายที่ Z ให้ไว้
ตัวอย่างแผนภาพ Moeller
เพื่อให้เข้าใจถึงวิธีการทำงานของไดอะแกรม Moeller ได้ดีขึ้น ด้านล่างนี้ เราจะไปดูตัวอย่างการใช้งานจริงบางประการของการตั้งค่าการกำหนดค่าอิเล็กตรอนขององค์ประกอบต่างๆ
เบริลเลียม
เพื่อสร้างการกำหนดค่าทางอิเล็กทรอนิกส์ของอะตอมเบริลเลียมที่เป็นกลาง (Be) สิ่งที่เราต้องทำก่อนคือมองหามันในตารางธาตุ อัลคาไลน์เอิร์ ธ ที่อยู่ในคอลัมน์ที่สองและแถวที่สองของตาราง. เลขอะตอมของมันคือ 4 ดังนั้น Z = 4 และมีอิเล็กตรอน 4 ตัวด้วย
เมื่อพิจารณาทั้งหมดนี้ เราจะใช้แผนภาพ Moeller เพื่อดูว่าอิเล็กตรอน 4 ตัวขององค์ประกอบนี้ตั้งอยู่อย่างไร เราเริ่มต้นด้วยการทำเส้นทแยงมุมในความหมายดังกล่าวจากบนลงล่างและจากขวาไปซ้าย
เมื่อเราเติมออร์บิทัล ขอแนะนำให้ใส่จำนวนอิเล็กตรอนที่พบในแต่ละตัวเป็นตัวยก. เนื่องจาก 1s เป็นออร์บิทัลแรกและมันครอบครองอิเล็กตรอนสองตัว เราจะเขียนมันว่า:

เนื่องจากเรายังมีอิเล็กตรอนอิสระอยู่ เราจึงเติมออร์บิทัลต่อไป ถัดไปคือวงโคจร 2s และเช่นเดียวกับ 1s มันครอบครอง 2 อิเล็กตรอนดังนั้น 2s2 เนื่องจากเรามีอิเล็กตรอนทั้งหมดอยู่ในออร์บิทัลของอะตอมที่เป็นกลางของ Be อยู่แล้ว จึงกล่าวได้ว่าการกำหนดค่าทางอิเล็กทรอนิกส์ขององค์ประกอบนี้คือ:

ตรวจสอบให้แน่ใจว่าเราทำได้ดีโดยการเพิ่มตัวยก: 2 + 2 = 4
- คุณอาจสนใจ: "ทฤษฎีจลนศาสตร์โมเลกุล: สถานะของสสารทั้ง 3"
จับคู่
ธาตุฟอสฟอรัส (P) เป็นอโลหะที่พบในแถวที่สามและคอลัมน์ที่ 16 ของตารางธาตุโดยที่ Z = 15 จึงมีอิเล็กตรอนทั้งหมด 15 ตัวที่ต้องครอบครองออร์บิทัล
เมื่อดูตัวอย่างก่อนหน้านี้แล้ว เราก็สามารถเคลื่อนที่ไปข้างหน้าได้เล็กน้อยและค้นหาอิเล็กตรอน 4 ตัวของมัน ในออร์บิทัลเดียวกันกับที่เบริลเลียมมีสำหรับอิเล็กตรอน 4 ตัว ขาดอิเล็กตรอน 9 ตัว บวก

หลังจากวงโคจร 2 วินาที เส้นทแยงมุมถัดไปจะเข้าสู่วงโคจร 2p และสิ้นสุดที่วงโคจร 3 วินาที ออร์บิทัล 2p สามารถครอบครองอิเล็กตรอนได้ 6 ตัว และในกรณีของ 3s เพียง 2 ดังนั้น เราจะมี:
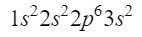
ขณะนี้เรามีอิเล็กตรอน 12 ตัวอยู่ในตำแหน่งที่ดี แต่เรายังมีอีก 3 ตัวที่จะไป เราสร้างเส้นทแยงมุมอีกอันและคราวนี้เราเข้าสู่วงโคจร 3p ตามแผนภาพ Moeller ซึ่งเป็นวงโคจรที่มีที่ว่างสำหรับอิเล็กตรอน 6 ตัวแต่เนื่องจากเราเหลืออิเลคตรอนเพียง 3 ตัว ออร์บิทัลนี้จะไม่ถูกครอบครองโดยสมบูรณ์ โดยกำหนดให้ 3 เป็นตัวยก ดังนั้น เพื่อยุติฟอสฟอรัส การกำหนดค่าทางอิเล็กทรอนิกส์มีดังนี้:

ตรวจสอบให้แน่ใจว่าเราทำได้ดีโดยการเพิ่มตัวยก: 2 + 2 + 6 + 2 + 3 = 15
เซอร์โคเนียม
ธาตุเซอร์โคเนียม (Zr) เป็นโลหะทรานซิชันที่พบในคอลัมน์ 4 และแถวที่ 5 และมี Z = 40. การย่อเส้นทางโดยใช้ประโยชน์จากตัวอย่างก่อนหน้านี้ เราสามารถระบุตำแหน่งของอิเล็กตรอน 18 ตัวแรกได้
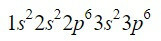
หลังจากออร์บิทัล 3p ออร์บิทัลถัดไปที่จะเติม ซึ่งแนะนำเราด้วยไดอะแกรม Moeller คือออร์บิทัล 4s, 3d, 4p และ 5s ที่มีความจุ 2, 10, 6 และ 2 อิเล็กตรอนตามลำดับ

การทำออร์บิทัลเก้าวงแรกในแผนภาพให้สมบูรณ์จะเพิ่มอิเล็กตรอนทั้งหมด 20 ตัว เหลืออิเลคตรอน 2 ตัวที่เหลืออยู่ในออร์บิทัลถัดไป คือ 4d. ดังนั้นการกำหนดค่าอิเล็กตรอนของเซอร์โคเนียมองค์ประกอบเป็นกลางคือ:
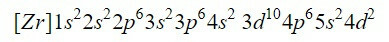
เราต้องแน่ใจว่าเราทำได้ดีโดยการเพิ่มตัวยก: 2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 2 + 2 = 40
ออกซิเจน
ในที่นี้เราจะเห็นตัวอย่างที่ซับซ้อนกว่าเล็กน้อย นั่นคือ ออกซิเจน (O). ก๊าซนี้มีอยู่ในคอลัมน์ที่ 16 และแถวที่ 2 ของตารางธาตุ เป็นธาตุอโลหะและมีเลขอะตอมเท่ากับ 8
จนถึงตอนนี้ เมื่อดูตัวอย่างอื่นๆ เราคิดว่า Z = 8 ของมัน อย่างไรก็ตาม มันไม่ง่ายนักเนื่องจากก๊าซนี้มีลักษณะพิเศษ เกือบจะอยู่ในรูปของไอออนที่มีประจุ -2 เสมอ
ซึ่งหมายความว่าแม้ว่าอะตอมออกซิเจนที่เป็นกลางจะมีอิเล็กตรอน 8 ตัวตามที่ระบุโดยเลขอะตอม แต่ก็มี มันเป็นความจริงที่ว่าในธรรมชาติมีมากกว่า ในกรณีของมันคือ 10 (8 อิเล็กตรอน + 2 อิเล็กตรอนหรือถ้าคุณต้องการ -8 ประจุ ไฟฟ้า -2).
ดังนั้น ในกรณีนี้ จำนวนอิเล็กตรอนที่เราต้องหาในออร์บิทัลไม่ใช่ 8 แต่เป็น 10 อิเล็กตรอนราวกับว่าเรากำลังหาตำแหน่งอิเล็กตรอนของธาตุเคมีนีออนที่มี Z = 10
เมื่อเข้าใจสิ่งนี้ เราแค่ต้องทำแบบเดียวกับที่เราทำในกรณีก่อนหน้านี้ โดยคำนึงถึงว่าเรากำลังทำงานกับไอออน (ไอออน) เท่านั้น:
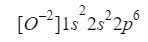
ตรวจสอบให้แน่ใจว่าเราทำได้ดีโดยการเพิ่มตัวยก: 2 + 2 + 6 = 10
แคลเซียม
สิ่งที่คล้ายกับออกซิเจนเกิดขึ้นกับแคลเซียม (Ca) เฉพาะในกรณีนี้เรากำลังพูดถึงไอออนบวกนั่นคือไอออนที่มีประจุบวก.
องค์ประกอบนี้มีอยู่ในคอลัมน์ 2 แถว 4 ของตารางธาตุที่มีเลขอะตอมเป็น 20 อย่างไรก็ตามใน ธรรมชาติมักจะนำเสนอในรูปของไอออนที่มีประจุบวก +2 ซึ่งหมายความว่าประจุไฟฟ้าของมันคือ 18 (- 20 + 2 = 18; 20 อิเล็กตรอน - 2 อิเล็กตรอน = 18 อิเล็กตรอน)
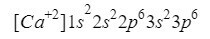
ตรวจสอบให้แน่ใจว่าเราทำได้ดีโดยการเพิ่มตัวยก: 2 + 2 + 6 + 2 + 6 = 18
ข้อยกเว้นของแผนภาพ Moeller และกฎของ Madelung
แม้ว่าแผนภาพ Moeller จะมีประโยชน์มากในการทำความเข้าใจกฎของ Madelung และเพื่อให้ทราบว่าอิเล็กตรอนขององค์ประกอบทางเคมีต่างๆ อยู่อย่างไร ความจริงก็คือว่าไม่มีข้อผิดพลาด มีสารบางอย่างที่องค์ประกอบไม่เป็นไปตามที่เราอธิบายไว้
การกำหนดค่าอิเล็กตรอนของพวกมันแตกต่างจากการทดลองที่ทำนายโดยกฎของ Madelung ด้วยเหตุผลทางควอนตัม. ในบรรดาองค์ประกอบเหล่านี้ที่ไม่เป็นไปตามมาตรฐานที่เรามี: โครเมียม (Cr, Z = 24), ทองแดง (Cu, Z = 29), เงิน (Ag, Z = 47), โรเดียม (Rh, Z = 45), ซีเรียม ( Ce, Z = 58), ไนโอเบียม (Nb; Z = 41) เป็นต้น
มีข้อยกเว้นบ่อยครั้งมากเมื่อเติมออร์บิทัล d และ f ตัวอย่างเช่น ในกรณีของโครเมียม ซึ่งควรมีการกำหนดค่าความจุที่ลงท้ายด้วย 4s ^ 2 3d ^ 4 ตามแผนภาพ Moeller และกฎของ Madelung จริงๆ แล้วมีการกำหนดค่าความจุเป็น 4s ^ 1 3d ^ 5 ตัวอย่างที่แปลกประหลาดอีกตัวอย่างหนึ่งคือ เงิน ซึ่งแทนที่จะมี 5s ^ 2 4d ^ 9 เนื่องจากอันสุดท้ายมี 5s ^ 1 4d ^ 10
