10 çeşit kimyasal bağ (örneklerle açıklanmıştır)
Kimyasal bağlar, atomları bir arada tutan kuvvetler molekülleri oluşturmak için. Atomlar arasında üç tür bağ vardır:
- Metalik bağ.
- İyonik bağ.
- Kovalent bağ: polar olmayan, polar, basit, çift, üçlü, datif.
Bu bağlar sayesinde doğada var olan tüm bileşikler oluşur. Moleküller arası bağlar olarak bilinen, molekülleri bir arada tutan kuvvetler de vardır, örneğin:
- Hidrojen bağları veya köprüleri.
- Dipol-dipol kuvvetleri.
Ardından, bu bağlantıların her birini açıklıyoruz.
| Kimyasal bağ türleri | karakteristik | Örnekler | |
|---|---|---|---|
| Metal | Metal iyonları, hareketli elektron denizinde yüzer. | Metalik elementler: sodyum, baryum, gümüş, demir, bakır. | |
| İyonik | Elektronların bir atomdan diğerine transferi. | Na sodyum klorür+Cl- | |
| kovalent | Polar olmayan | Elektronları iki atom arasında eşit olarak paylaşın. | Moleküler hidrojen H-H veya H2 |
| kutup | Elektronları iki atom arasında eşit olmayan bir şekilde paylaşın. | Su molekülü H2VEYA | |
| Basit | Bir çift elektron paylaşın. | Klor molekülü Cl2 Cl-Cl | |
| Çift | İki çift elektronu paylaşın. | Oksijen molekülü O2 O = O | |
| üçlü | Üç çift elektron paylaşın. | Azot molekülü N≣N veya N2 | |
| datif | Atomlardan sadece biri elektronları paylaşır. | Amonyak-bor triflorür bileşiğinde nitrojen ve bor arasındaki bağ. | |
| moleküller arası kuvvetler | hidrojen köprüsü | Bir moleküldeki hidrojenler, başka bir molekülün elektronegatif atomlarına çekilir. | Hidrojen, bir su molekülündeki hidrojen ile başka bir su molekülündeki oksijen arasındaki bağdır. |
| dipol-dipol | İki elektrik kutbuna sahip moleküller, diğer moleküllerin zıt kutuplarını çeker. | Metanal H molekülleri arasındaki etkileşimler2C = O |
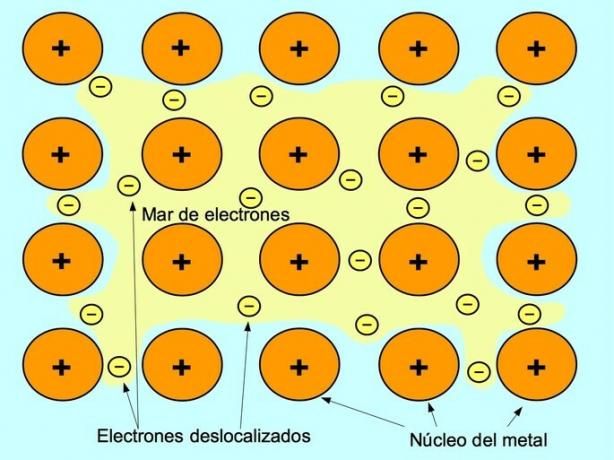
metalik bağ
Metalik bağ, metalik elementlerin pozitif iyonları ile iyonlar arasında serbest hareket eden negatif elektronlar arasındaki çekim kuvvetidir. Metal atomları sıkıca paketlenmiştir, bu elektronların atom kafesi içinde hareket etmesine izin verir.
Metallerde, değerlik elektronları orijinal atomlarından salınır ve tüm metal yapının etrafında yüzen bir elektron denizi oluşturur. Bu, metal atomlarının birlikte paketlenen pozitif yüklü metal iyonlarına dönüşmesine neden olur.
Metalik bağ, sodyum Na, baryum Ba, kalsiyum Ca, magnezyum Mg, altın Au, gümüş Ag ve alüminyum Al gibi metalik elementler arasında kurulur.
İyonik bağ
İyonik bağ, sodyum veya magnezyum gibi metalik bir elementi klor veya kükürt gibi metalik olmayan bir elementle birleştiren kuvvettir. Metal elektron kaybederek pozitif metal iyonuna dönüşür. katyon. Bu elektronlar metalik olmayan elemente geçer ve adı verilen negatif yüklü bir iyona dönüşür. anyon.
Katyonlar ve anyonlar birleşir ve farklı yüklere sahip iyonlar arasındaki elektrostatik çekim kuvvetleri tarafından sürdürülen üç boyutlu bir ağ oluşturur. Bu kuvvetler iyonik bileşikler oluşturur.
Yerkabuğu esas olarak iyonik bileşiklerden oluşur. Çoğu kaya, mineral ve değerli taş iyonik bileşiklerdir. Örneğin:
- Sodyum Klorür NaCl: metalik element, bir elektronu metalik olmayan element olan klora aktaran sodyumdur.
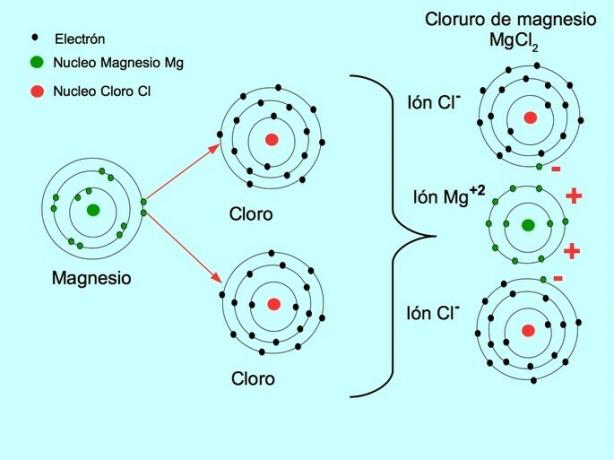
- Magnezyum Klorür MgCl2: Magnezyum Mg, aşağıdaki şekilde gösterildiği gibi iki klor atomuna iki elektron verir:
Ayrıca bakınız Katyonlar ve anyonlar arasındaki fark.
Kovalent bağ
Kovalent bağ, metalik olmayan iki atom elektronları paylaştığında oluşur. Bu bağ, atomların elektronlarının afinitesine ve paylaşılan elektronların miktarına bağlı olarak çeşitli tiplerde olabilir.
polar olmayan kovalent bağ
Polar olmayan kovalent bağ, elektronların eşit olarak paylaşıldığı iki atom arasında oluşan bağdır. Bu bağ normalde simetrik moleküllerde, yani hidrojen molekülü H gibi iki eşit atomdan oluşan moleküllerde oluşur.2 ve oksijen molekülü O2.

polar kovalent bağ
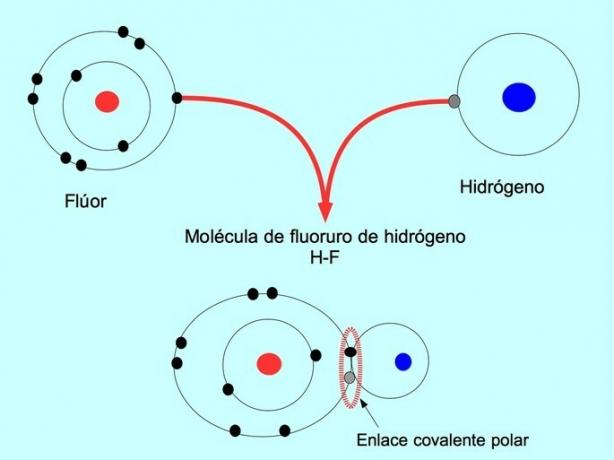
Polar kovalent bağ, iki atom elektronları paylaştığında oluşur, ancak bunlardan biri elektronlar için daha büyük bir çekiciliğe sahiptir. Bu, molekülün daha fazla elektronlu daha negatif bir "kutup"a sahip olmasını ve karşı kutbun daha pozitif olmasını sağlar.
Elektronların bu dağılımına veya dengesizliğine sahip moleküller polar olarak bilinir. Örneğin hidrojen florür HF'de hidrojen ve flor arasında kovalent bir bağ vardır, ancak florin elektronegatifliği daha yüksektir, bu nedenle elektronları daha güçlü bir şekilde çeker paylaşıldı.
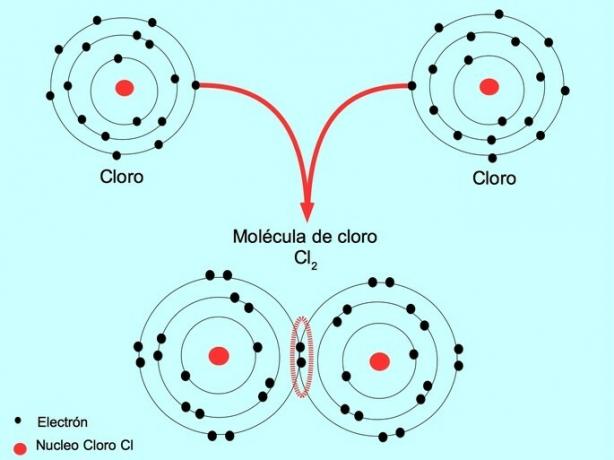
Basit kovalent bağ
İki atom, her birinden birer tane olmak üzere iki elektronu paylaştığında oluşan kovalent bağa tekli kovalent bağ denir.
Örneğin klor, dış kabuğunda sekiz elektronla doldurulabilen yedi değerlik elektronuna sahip bir atomdur. Bir klor, klor molekülü Cl'yi oluşturmak için başka bir klor ile birleşebilir.2 tek başına klorlardan çok daha kararlıdır.
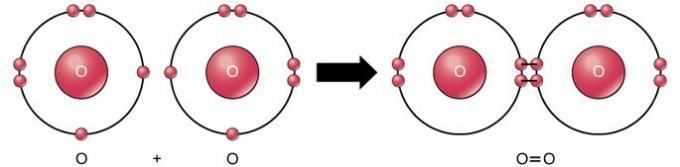
Çift kovalent bağ
Çift kovalent bağ, iki atom arasında dört elektronun (iki çift) elektronun paylaşıldığı bağdır. Örneğin oksijenin son kabuğunda 6 elektron bulunur. İki oksijen birleştirildiğinde, ikisi arasında dört elektron paylaşılır ve her birinin son kabukta 8 elektron olmasına neden olur.
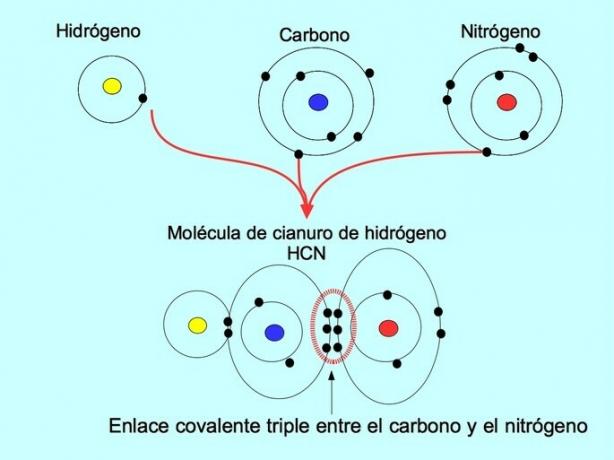
üçlü kovalent bağ
Üçlü kovalent bağ, iki atom arasında 6 elektron (veya üç çift) paylaşıldığında oluşur. Örneğin, hidrojen siyanür molekülü HCN'de, aşağıdaki şekilde gösterildiği gibi karbon ve azot arasında üçlü bir bağ oluşur:
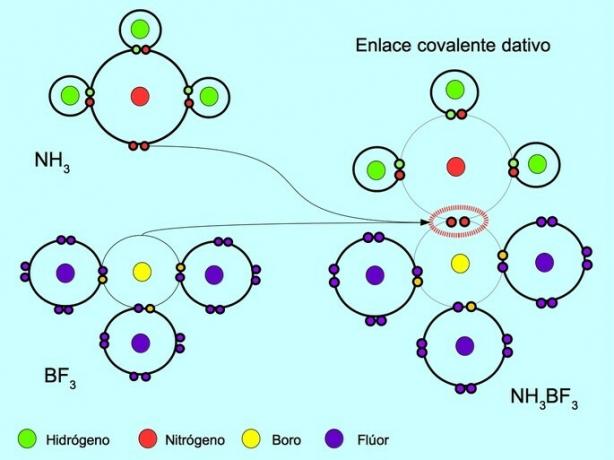
Koordinat veya datif kovalent bağ
Koordineli veya datif kovalent bağ, bağdaki atomlardan yalnızca biri bir çift elektrona katkıda bulunduğunda oluşan bağdır. Örneğin, amonyak NH reaksiyona girdiğinde3 bor triflorür BF ile3, Nitrojen, iki elektronla doğrudan paylaşacak elektronu olmayan bora bağlanır. Bu şekilde hem nitrojen hem de bor, değerlik kabuğunda 8 elektronla bırakılır.
Ayrıca bakınız Organik ve inorganik bileşikler.
moleküller arası bağlantılar
Moleküller, sıvı veya katı halde maddeler oluşturmayı mümkün kılan kuvvetler aracılığıyla birleşir.
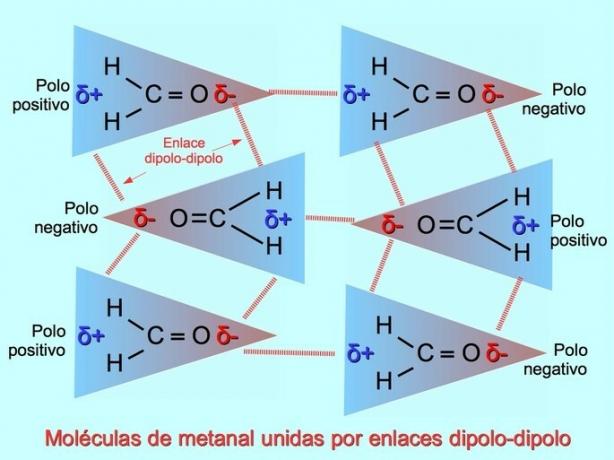
Dipol-dipol bağları veya kuvvetleri
Negatif kutuplar pozitif kutuplara çekildiğinde ve bunun tersi olduğunda, polar moleküller arasında zayıf moleküller arası bağlar kurulabilir. Örneğin, metal H2C = O, oksijen üzerinde kısmi negatif ve hidrojenlerde kısmi pozitif yüke sahip polar bir moleküldür. Bir metanal molekülün pozitif tarafı, başka bir metanal molekülün negatif tarafını çeker.
Hidrojen bağları veya bağları
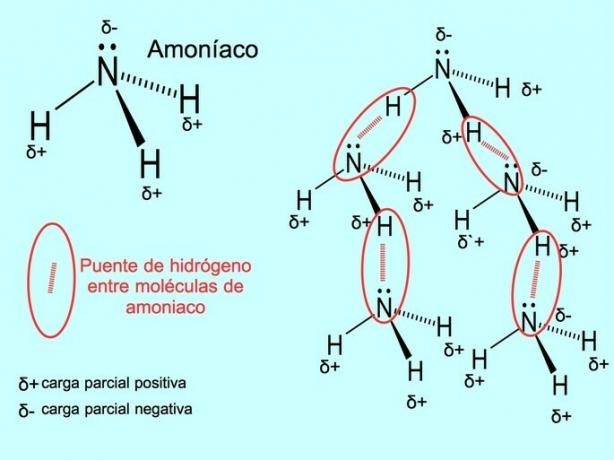
Hidrojen bağı veya hidrojen bağı, moleküller arasında kurulan bir bağdır. Moleküldeki bir hidrojen, bir oksijene, bir nitrojene veya bir florine kovalent olarak bağlandığında meydana gelir. Oksijen, nitrojen ve flor, elektronegatifliği daha yüksek atomlardır, bu nedenle elektronları daha az elektronegatifliğe sahip başka bir atomla paylaştıklarında daha güçlü bir şekilde çekerler.
Su molekülleri H arasında hidrojen bağları vardır.2O ve amonyak NH3 resim gösterdiği gibi:
Görmek ilginizi çekebilir:
- Atomlar ve moleküller.
- Organik ve inorganik bileşiklere örnekler.
- Metaller ve metal olmayanlar
Referanslar
Zumdahl, S.S., Zumdahl, S.A. (2014) Kimya. Dokuzuncu Baskı. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Kimya 1. 5. baskı. Pearson Avustralya. Melbourne.