Asit ve bazların özellikleri: temel farklılıklar
Asitlerin ve bazların özellikleri, bir asit ve bir baz arasında ayrım yapabileceğimiz tüm özellikler ve niteliklerdir.
Arrehnius'un teorisine göre, bir asit H protonlarını serbest bırakan bir maddedir+ suda çözündüğünde ve baz hidroksil iyonları OH salan herhangi bir maddedir- sulu çözelti içindeyken.
| asitler | bazlar | |
|---|---|---|
| iyon oluşumu | Mevcut | Mevcut |
| Nötrleştirme reaksiyonu | Bir baz ile reaksiyona girdiğinde. | Bir asit ile reaksiyona girdiğinde. |
| Su çözünürlüğü | Çözünür | Kısmen çözünür. Kalsiyum, baryum ve alüminyum hidroksitler az çözünür. |
| Elektrik iletkenliği | Mevcut | Mevcut |
| Maddenin durumu | Katı, sıvı veya gaz | Katı, sıvı veya gaz |
| Turnusol kağıdı ile reaksiyon | kırmızı boyama | mavi boyama |
| PH değeri | 7 yaş altı | 7'den büyük |
| eşlenik karşılığı | Zayıf bir asit bir eşlenik baz oluşturur. | Zayıf bir baz, konjuge bir asit oluşturur. |
| aşındırıcı etki | Güçlü asitler | Güçlü bazlar |
Asitlerin özellikleri
Asitler, tanımlanabilecekleri çeşitli özelliklere sahiptir.
Asitlerden iyon oluşturma yeteneği
Asidik maddelerin temel özelliği iyonize olabilmeleri yani elektron kaybetmeleri veya kazanmalarıdır.
Güçlü bir asit olan hidroklorik asit HCl, klorür anyonu Cl oluşturmak üzere iyonlaşır- ve proton H+.
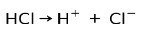
Nötrleştirme reaksiyonu
Bir asit, bir baz ile reaksiyona girerek bir tuz ve su oluşturur. Bu reaksiyon olarak bilinir Nötrleştirme reaksiyonu. Örneğin, HCl, sodyum klorür NaCl (mutfak tuzu) ve su oluşturmak üzere NaOH ile reaksiyona girer:
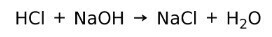
Asitlerin suda çözünürlüğü
Asitler genellikle suda çözünür. Örneğin, hidroklorik asit veya muriatik asit suda orta derecede çözünür, 0ºC'de 100 ml suda 82 g'a kadar HCl çözülebilir. Sülfürik asit H durumunda2GB4, su ile karışım ısı üretir, bu nedenle patlamaları önlemek için her zaman suya asit eklenmesi tavsiye edilir.
asit gücü
Asitlerin nasıl ayrıştığı, güçlü veya zayıf olup olmadıklarını belirler. Bir asidin gücü, onun tarafından verilir. Ayrışma sabiti.
Nitrik asit HNO3 bu bir güçlü asit çünkü sulu çözeltide tamamen protonlara ve nitrat iyonlarına iyonlaşır:

Bu, HNO eklediğimizde3 suda, suyu analiz ederken sadece H bulacağız+ ve nitrat iyonları ve neredeyse hiç HNO yok3.
Bunun yerine sirkede bulunan asetik asit, zayıf asit, çünkü sadece bir kısmı ayrışmıştır:
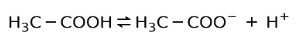
Bu nedenle, iki yönde oklarla temsil edilir, bu, sulu çözeltide asetik asit, H alacağımız anlamına gelir.+ ve asetat anyonu (H3C-COO-).
Asitlerin halleri
Asitler sıvı, katı veya gaz halinde bulunabilir. Örneğin, hidroklorik asit HC1 sıvıdır, hidrojen sülfür HS gazdır ve oksalik asit katıdır.
Asitlerden turnusol kağıdı ile reaksiyon

Asidik bir maddeye turnusol kağıdı şeridi koyduğumuzda turnusol kağıdı kırmızıya döner.
Asitlerin pH'larına göre tanımlanması
PH, H miktarının ölçüsüdür+ bir çözelti içinde bulunur. Böylece pH 0 ile 7 arasında bir asidin mevcudiyetini yaşıyoruz. Örneğin, sirkenin pH'ı 2'ye eşittir, araba akülerindeki sülfürik asidin pH'ı 1'e eşittir.
Asitlerin elektriksel iletkenliği
Asitler ayrışabildiğinden ve elektrik yüklü iyonlar üretebildiğinden, asidik çözeltiler elektriği iletebilir. Örneğin araba akülerinde elektrik iletkeni olarak güçlü bir asit olan sülfürik asit kullanılır.
Güçlü asitlerin aşındırıcı etkisi
Güçlü asitlerin aşındırıcı etkisi vardır, organik dokuları yakabilirler, bu nedenle kullanımları son derece dikkatli olmalıdır.
Zayıf asitler konjuge bir muadili oluşturur
Zayıf asitler çözündüklerinde eşlenik çift olarak bilinen şeyi oluştururlar, yani zayıf asit bir eşlenik bazı oluşturur.
Örneğin:

Bu durumda formik veya metanoik asit (HCOOH), ayrıştığında konjuge baz iyon biçimini oluşturur.
İlginizi çekebilir:
- Kuvvetli ve zayıf asitler ve bazlar.
- Asit ve baz örnekleri.
Bazların özellikleri
Daha sonra, onları karakterize eden bazların veya alkali çözeltilerin özelliklerini sunuyoruz.
Baz iyonizasyon kapasitesi
Bazik veya alkali maddeler, suda çözündüklerinde iyon oluşturmalarıyla karakterize edilir:

Bu durumda, sodyum hidroksit NaOH iyonlaşarak bir hidroksit anyonu OH oluşturur.- ve bir sodyum katyonu Na+.
Bir baz, bir tuz oluşturmak için bir asit ile reaksiyona girer
Bir baz, bir nötralizasyon reaksiyonunda bir asit ile reaksiyona girerek su ve bir tuz oluşturur, örneğin:

Bu durumda, alüminyum hidroksit Al (OH)3, bir baz, HC1 ile reaksiyona girer ve alüminyum klorür tuzu AlCl'yi oluşturur3 ve su. Alüminyum hidroksit, mide tarafından üretilen asidi nötralize ederek gastrik reflüyü rahatlatmak için bir antasit olarak kullanılır.
Bazlar suda çözünürlük
Bazı bazlar suda çözünür. Kalsiyum hidroksit ve baryum hidroksit gibi alkali toprak hidroksitler suda az çözünür. Örneğin, sodyum hidroksit veya kostik soda, 20ºC'de 100 ml suda 109 g çözülebilir. Magnezyum hidroksit veya magnezyum sütü Mg (OH) iken2 pratikte suda çözünmez.
taban gücü
Bazın iyonlaşma derecesine bağlı olarak bunlar güçlü veya zayıf olabilir. Örneğin, lityum hidroksit bir güçlü taban çünkü sulu çözeltide tamamen hidroksit iyonları OH ve lityum Li katyonlarına iyonlaşır+:
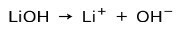
Öte yandan, amonyak NH3 bir zayıf taban çünkü su ile temas ettiğinde tüm amonyak ayrışmaz:
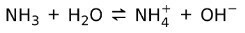
Bazların Durumu
Bazlar katı, sıvı ve gaz hallerinde bulunabilir. Örneğin, saf sodyum hidroksit katıdır, amonyak bir gazdır.
Bazların turnusol kağıdı ile reaksiyonu
Alkali bir maddeye turnusol kağıdı şeridi koyduğumuzda kağıt maviye döner.
Bazların pH'larına göre tanımlanması
Bazlar, 7 ile 14 arasında bir pH'a sahip olmaları ile karakterize edilir.
 Bazların elektriksel iletkenliği
Bazların elektriksel iletkenliği
Bazlar iyonlaşma kapasitelerinden dolayı elektriği iyi iletirler. Örneğin alkalin pillerde elektrik iletkeni olarak potasyum hidroksit KOH kullanılır.
Bazların aşındırıcı etkisi
Güçlü bazlar organik dokulara zarar verebilir. Örneğin, mutfak fırını temizleyicileri genellikle güçlü bazlardır ve bunların her zaman aşırı dikkatli, eldiven ve koruyucu gözlük takılarak kullanılması tavsiye edilir.
Zayıf bazlar eşlenik bir muadili oluşturur
Zayıf bazlar çözündüklerinde konjuge bir muadili oluşturur, yani zayıf bir baz konjuge bir asit oluşturur.
Örneğin, tris- (hidroksimetil) amino metan (OHCH2)3CNH2 konjuge asidi (OHCH) olan zayıf bir bazdır.2)3CNH3+:
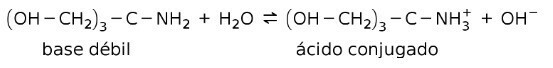
Bu, tampon maddelerin etkisinin temelidir veya tamponÇözeltilerin pH'ını sürekli olarak korumak için kullanılan maddelerdir.
Aşağıdakiler arasındaki farkları bilmek ilginizi çekebilir:
- Asitler ve bazlar.
- Katyonlar ve anyonlar



