10 çeşit kimyasal element (açıklanmış ve sınıflandırılmış)
Evrende kaç tane kimyasal element bulunmalıdır? Bilim adamları zaman zaman kendi yapay kimyasal elementlerini yarattıklarından, bu sorunun daha gidecek çok yolu var.
Ancak, cevaplayabileceğimiz şey şudur: kaç çeşit kimyasal element bulunmalıdır, daha sonra öğreneceğimiz bir şey.
- İlgili makale: "11 çeşit kimyasal reaksiyon"
Kimyasal element türleri
Doğada her türlü maddeyi bulabiliriz. Bu maddeler genellikle saf halde bulunmazlar, ancak farklı maddelerin kombinasyonunun sonucudurlar. farklı tepkimeler, süreçler ve zaman dilimleri yoluyla her türlü Önemli olmak. Evrende farklı kimyasal elementlere ait atomların bir araya gelmesi sonucu oluşmayan hiçbir şey yoktur., ki biz derinlemesine göreceğiz.
Ancak, kimyasal element türlerine bakmadan önce lise bilimine biraz göz atalım ve kimyasal elementlerin ne olduğunu hatırlayalım.
Aynı cins atomdan oluşan maddeye, yani atomik olarak saf olan maddeye "kimyasal element" diyoruz. Kimyasal elementler daha basitlerine ayrıştırılamazlar ve periyodik tabloda sınıflandırılırlar. Evrenin saf malzemeleri olarak elementlerin
Ama dikkat et! Elementleri basit maddelerle karıştırmamalıyız, çünkü bazı durumlarda aynı elementin iki veya daha fazla atomu bir araya gelebilir. Söz konusu elementin bazı fiziksel özelliklerinin değişmesine neden olan farklı şekillerde gruplanan moleküller, bu durumlarda izotoplar. Örneğin, elmas ve karbon, kimyasal element karbondan (C) yapılan maddelerdir. Ancak farklı şekillerde düzenlenir ve tamamen farklı iki malzemeyle sonuçlanır.
Carl sagan yıldızlara yansıyan yıldız tozu olduğumuzu söyledi. Bu güzel söz sadece bir metafor değil, bilimsel bir gerçektir. Kimyasal elementler, bildiğimiz kadarıyla, yıldızların içinde karmaşık olaylar sonucu oluşur. olarak adlandırılan bir sürecin sonucu olarak giderek daha ağır elementler üreten füzyon ve atomik fisyon süreçleri. nükleosentez.
Bilinen elementlerin çoğu doğadan elde edilebilir., kendiliğinden bulunan veya uranyum (U), karbon (C), silikon (Si), gümüş (Ag) veya altın (Au) gibi diğer elementlerle bileşikler oluşturur. Ancak diğerleri, americium (Am), berkelium (Bk) veya curium (Cm) gibi laboratuvarlarda üretilmiştir. Onu elde etme yöntemi ne olursa olsun veya doğada mevcutsa, özelliklerine bağlı olarak, söz konusu kimyasal elementin bazı kullanımları veya başkaları olacaktır.
Şu anda yaklaşık 118 kimyasal element bilinmektedir, ancak insanların yeni elementler üretebildikleri göz önüne alındığında, periyodik tablonun genişlemesi an meselesidir.
- İlginizi çekebilir: "2 tür elektrik (açıklandı)"
Ana kimyasal element türleri
Ana kimyasal element türleri, bir sistem olan periyodik tabloda temsil edilir. Rusya'da temellerini atan Rus kimyager Dmitri Mendeleev (1834-1907) tarafından oluşturulan sınıflandırma. 1869. Kimyasal elementler, özelliklerine ve özelliklerine göre görsel olarak sıralanır.
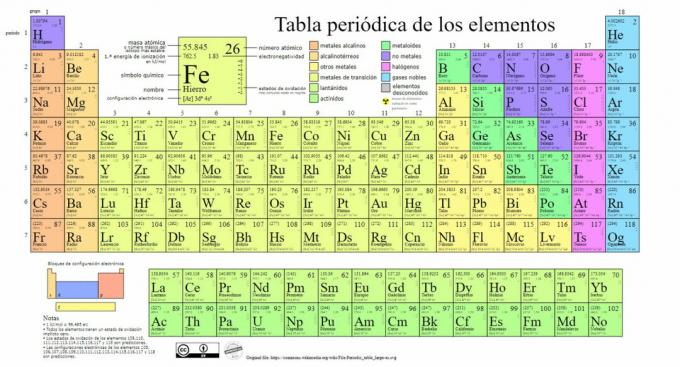
Zaman geçtikçe ve kimya önemli bilimsel keşifler yaptıkça, bu tablo art arda genişletilecekti., bugüne kadar bilinen 118 element ile bugünkü formuna ulaşıyor.
Şu anda, bu tabloda aşağıdaki kimyasal element türlerini bulabiliriz:
1. metaller
metaller Atomlarının son yörüngesinde genellikle bir ila üç elektron içeren, elektronları kolayca aktarılabilen kimyasal elementler onları ısı ve elektrik iletkeni yapar.
Metaller genellikle dövülebilir ve sünektir, yoğunluğu atomlarını oluşturan elektronların hareketine bağlı olan karakteristik bir parlaklığa sahiptir. Çoğu zaman, metaller cıva hariç oda sıcaklığında katıdır.
Metaller arasında, fiziksel özellikleri onları muhteşem elektrik iletkenleri yapan altın (Au), gümüş (Ag), bakır (Cu) ve alüminyum (Al) buluyoruz., doğadaki varlıkları çok çeşitli olmasına rağmen, ağırlıkları arasındaki farka yansır.
Doğada bulunan kimyasal elementlerin %75'inin metaller, kalan %25'inin ise soy gazlar, metaloidler ve diğer türlerden oluşacağına inanılmaktadır.
Bu kategoride aktinitleri, lantanitleri, geçiş metallerini, alkali metalleri, toprak alkali metalleri ve diğer metalleri bulan sınıflandırmalar vardır.
- İlgili makale: "Çinko içeriği yüksek 10 yiyecek"
1.1. Lantanitler
Lantanit elementleri, birçok mineralden oluşan tortularda bulunur. Hava ile temas ettiğinde kolayca oksitlenen beyaz metallerdir.. Bunların arasında Lanthanum (La), Promethium (Pm), Europium (Eu) ve Ytterbium (Yb) bulunur.

- İlginizi çekebilir: "5 çeşit kimyasal bağ: madde böyle oluşur"
1.2. aktinitler
Aktinitlerin tüm izotopları radyoaktiftir. Bunların arasında aktinyum (Ac), uranyum (U), plütonyum (Pu) ve einsteinium (Es) bulunur.
1.3. Geçiş metalleri
Geçiş metalleri, periyodik sistemin orta kısmında bulunur. Başlıca özelliği, kısmen elektronlarla dolu "d" orbitalinin elektronik konfigürasyonuna sahip.
Bu grupta her çeşit madde bulunur ve en geniş sınıflandırmasına göre 21'den 30'a, 39'dan 48'e kadar kimyasal elementlere karşılık gelir, 71'den 80'e ve 103'ten 112'ye toplam kırk olmak üzere vanadyum (V), rutenyum (Ru), gümüş (Ag), tantal (Ta) ve lavrencio buluruz. (Lr).

1.4. Alkali metaller
Alkali metaller, lityum (Li), sodyum (Na), potasyum (K), rubidyum (Rb), sezyum (Cs) ve fransiyumdan (Fr) oluşan altı elementten oluşan bir gruptur.. Parlak, yumuşak metallerdir, normal sıcaklık ve basınçta oldukça reaktiftirler ve "s" yörüngelerinde bulunan dış elektronlarını kolayca kaybederler.
1.5. alkali topraklar
Alkali toprak metalleri, içinde berilyum (Be), magnezyum (Mg), kalsiyum (Ca), stronsiyum (Sr), baryum (Ba) ve radyum (Ra) bulduğumuz bir grup elementtir. Adı, bazik veya alkali özelliklere sahip olan oksitlerine, yani "topraklara" verilen addan gelir.
alkali topraklar alkaliden daha serttirler, parlarlar ve iyi elektrik iletkenleridirler.. Alkali olanlardan daha az reaktiftirler ve iyi indirgeyici ajanlar olarak hareket ederler. İyonik bileşikler oluşturma yeteneğine sahiptirler ve hepsinin en dış kabuğunda iki elektron bulunur.

1.6. Diğer metaller
"Diğer metaller" kategorisi onları nereye koyacağınızı gerçekten bilmediğiniz için burada bulunan bir tür madde.
Metaloidlerle birlikte periyodik tabloda p bloğu içinde yer alan metalik elementlerdir. Düşük erime noktaları ile yumuşak olma eğilimindedirler. Bunlar arasında alüminyum (Al), indiyum (In), kalay (Sn) ve bizmut (Bi) bulunur.

2. Metal yok
Ametaller genellikle son yörüngelerinde beş ila yedi elektrona sahiptirler. onlardan vazgeçmek yerine elektron kazandıklarını ve böylece onları sabitleyen sekiz elektrona sahip olmayı başarırlar. atomlar.
Bu elemanlar ısı ve elektriği çok zayıf iletirler. Buna ek olarak, karakteristik bir parlaklığa sahip değiller, çok dövülebilir değiller, çok sünek değiller ve katı halde çok kırılganlar. Metallerin aksine yuvarlanamaz veya gerilemezler.
Çoğunlukla biyolojik sistemler için gereklidirler, çünkü içinde bulundukları kükürt (S), karbon (C), oksijen (O), hidrojen (H) gibi organik bileşikler ve iyot (I).

- İlgili makale: "20 çeşit değerli taş (açıklamalı ve resimli)"
3. metaloidler
Adından da anlaşılacağı gibi, metaloidler her iki grubun özelliklerine sahip metaller ve metal olmayanlar arasında bir ara sınıflandırma. Bunun nedeni, son yörüngelerinde metallerin ve metal olmayanlarınkine göre bir ara miktar olan dört atoma sahip olmalarıdır.
Bu kimyasal elementler elektriği metallerde olduğu gibi ters yönde yapmasına izin vermeden yalnızca bir yönde iletir. Bunun bir örneği, bu özelliği sayesinde elektronik endüstrisi için yarı iletken elemanların üretiminde kullanılan bir metaloid olan silikonda (Si) bulunur.
Diğer metaloidler şunlardır: bor (B), arsenik (As), antimon (Sb) ve polonyum (Po).

4. halojenler
Halojenler, altı elementten oluşan bir gruptur. elektronegatiflikleri nedeniyle kimyasal olarak çok aktif iki atomdan (diatomik) oluşan moleküller oluşturma eğilimindedirler..
Bu maddeler genellikle iyonlar, yani bu durumda mononegatif, yüksek oranda oksitleyici olan elektrik yüklü moleküller şeklinde görünürler. Bu, halojenlerin yakıcı ve aşındırıcı maddeler olduğu anlamına gelir.
Halojenler şunlardır: flor (F), klor (Cl), brom (Br), iyot (I), astat (At) ve tenez (Ts).

5. soy gazlar
Soy gazlar, doğal hali gaz halinde olan yedi kişilik bir gruptur. Genellikle çok düşük reaktiviteye sahip iki atomlu moleküller şeklinde görünürler, yani diğer maddeleri oluşturan diğer elementlerle reaksiyona girmezler. ve aynı nedenle inert gazlar olarak bilinirler. Bunun nedeni, son yörüngesinde o seviye için mümkün olan maksimum elektron sayısı, toplamda sekiz olmasıdır.
Bu seçkin element grubu, daha önce ununoktiyum olarak bilinen helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe), radon (Rn) ve oganesondan (Og) oluşur.


