KİMYASAL FORMÜLLER nedir ve ne içindir [ÖZET + VİDEOLAR]
Öyle görünmese de, periyodik tablonun kimyasal elementleri Her taraftan bizi kuşatıyorlar. Bununla birlikte, çoğu zaman ayrı ayrı bulunmazlar, daha çok çeşitli kimyasal elementlerin moleküllerini veya makromoleküllerini oluştururlar. Kimyasal formüller bu bileşiklerin grafik ifadesidir ve isimlendirmelerini standardize etmek için kullanılır. Bir ÖĞRETMENden bu derste göreceğiz kimyasal formüller nedir ve ne işe yarar. Daha fazlasını öğrenmek için bize katılın!
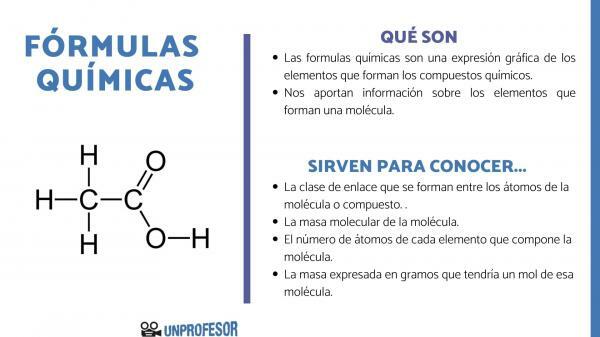
NS kimyasal formüller oluşturan öğelerin grafik bir ifadesidir. kimyasal bileşikler.
Bu kimyasal formüller keyfi değildir, ancak bazılarına uyun. katı kurallar tarafından oluşturulan kimyasal isimlendirmenin IUPAC (Uluslararası Saf ve Uygulamalı Kimya Birliği).
Kimyasal formüller de bize molekülü oluşturan elementler, bu nedenle, örneğin, bize onu oluşturan atomların her birinin sayısını ve ilgili oranlarını ve hatta bazen türünü bile söyler. Kimyasal bağ bu elemanlar arasında var olan.
Var olan her molekül veya makromolekül, kimyasal formülüne karşılık gelir, ancak
farklı formül türleri. Bu türlerin her biri bize molekül hakkında farklı bilgiler verir, ancak hepsi molekülün yapısını anlamamıza yardımcı olur. kimyasal doğa ve kimyasal reaksiyonlarda neler olduğunu ve bir bileşiğin diğerlerine nasıl dönüşebileceğini anlamamıza yardımcı olur.Ancak bu kimyasal terminolojiyi anlamak için kimya konusunda belirli bir bilgiye sahip olmak gerekir, çünkü bunlar oldukça uzmanlaşmış bir teknik dile uyarlar.

Resim: Slayt Oynatıcı
NS kimyasal formüller tarafından temsil edilirler kimyasal sembollerin birliği, içinde geldiği gibi her atomun karşılık gelen harfi ile periyodik tablo, ve bunların miktarını temsil eden sayılar olan abonelikler atomlar molekülde
Kimyada (hem organik hem de inorganik) belirli parçalar veya bileşikler vardır. hem yapısal hem de işlevsel olarak belirli bir yineleme gösterir ve isimlerle tanımlanır özel. Bu fragmanlar paylaşılmayan serbest elektronlara sahip olduklarında, radikaller olarak adlandırılırlar ve bunlar kararsız, kısa yarı ömürlü, oldukça reaktif bileşiklerdir.
Radikal örnekleri şunlardır: metil grupları CH3, nitrat grupları NO3, hidroksil grupları OH- veya radikal Cl-. Bununla birlikte, bir zincire bağlı atomlar veya atom grupları olduklarında fonksiyonel gruplar olarak bilinirler. karbon dioksit (çeşitli karbonlu) ve reaktivitesinden ve kimyasal özelliklerinden sorumlu olan moleküller.
Bu gruplar organik kimyada özellikle önemlidir (insan biyomolekülleri temel olarak karbon ve hidrojendir). Bazı fonksiyonel grup örnekleri karbonil grubu = C = O veya karboksil grubu -COOH.

Resim: Monogramas.com
Dediğimiz gibi, birkaç çeşit kimyasal formül vardır. Bu formüllerin her biri bize moleküller hakkında farklı türde bilgiler verir ve bu nedenle, genel anlamda herhangi bir formül diğerinden daha iyi veya daha kötü olmadan belirli bir amaca hizmet eder.
Ayırdığımız kimyasal formül sınıfları şunlardır:
ampirik formüller
Ampirik formüller, kimyasal bir molekülü temsil eden en basit formüllerdir ve bazen bunların minimal formüller olduğunu söylerler. Bu formüller, moleküldeki her bir elementin atomlarının tam sayılara basitleştirilmiş, her zaman en küçük olan oranını temsil eder. Bu formülün bir örneği, üç hidrojen atomu ve bir karbon atomu içeren CH3'tür (metil grubu).
Ancak bu formüller bazen molekülün bileşimi hakkında yanılgılara yol açabilmektedir. Bu, formül, peroksitte olduğu gibi moleküldeki gerçek atom sayısını göstermediğinde meydana gelir. Formülün H2O2 olması gerektiğinde ampirik formülü H O olan hidrojen (iki hidrojen atomu ve iki oksijen). Bu, bir isimlendirme kuralı aracılığıyla gerçekleşir, çünkü her iki alt simge de eşit olduğundan, basitleştirilirler.
Ancak bazı bileşikler, iyon ağlarından oluştukları için yalnızca ampirik formüllerle temsil edilebilirler. Bu, örneğin, her sodyum için bir klorin olduğunu gösteren NaCl olarak gösterilen adi tuz veya sodyum klorürde meydana gelir.
moleküler formüller
Bu tür formüller oldukça basittir, sadece bir kovalent molekülde bulunan atomların türünü ve her birinin sayısını ifade ederler. Kimyasal elementleri ve sayıyı doğrusal bir şekilde (bir alt simge şeklinde) sunan formüllerdir. Bu tür formülün bir örneği, glikozun C6H12O6 olarak adlandırılmasıdır; bu, glikozu ifade eder. Glikoz molekülü altı karbon atomu, on iki hidrojen atomu ve altı oksijen.
Moleküler formüller yaygın olarak kullanılmaktadır ve bazen bunların moleküllerin gerçek formülleri oldukları söylenmektedir. Çoğu durumda, örneğin CO2'de, ampirik formüllerle örtüşürler.
Yarı geliştirilmiş formüller
Yarı gelişmiş formüller, molekülü oluşturan atomları ve sayılarını da ifade ettikleri için moleküler formüllere benzer bir formül türüdür. Kimyasal bağlar (atomlar arasındaki çizgilerle gösterilir) ve onu oluşturan karbon atomları arasındaki bağın türü (basit, çift veya çift ise) hakkında bilgi sağlar. üçlü). Yarı geliştirilmiş formül, molekülü ve kimyasal yapısını oluşturan radikalleri tanımlamak için yararlıdır (karbon ve hidrojen atomları arasındaki bağlar temsil edilmez).
Glikoz durumunda, yarı gelişmiş formülü CH2OH - CHOH - CHOH - CHOH -CHOH - CHO'dur ve görüldüğü gibi karbon, hidrojen ve oksijen moleküler formüldeki ile aynıdır (sırasıyla altı, on iki ve altı) ve tüm tekli bağlar (sadece glikozun bağları vardır) basit). Bu formül bu nedenle moleküler formülden daha karmaşık bir formüldür.
Yarı gelişmiş formüllere bazen yoğunlaştırılmış denir ve belki de en yaygın kullanılan formül sınıfıdır. Moleküllerin gerçek geometrisini gözlemlememize izin vermese de özellikle organik kimyada kullanılır.
geliştirilmiş formül
Geliştirilen formüller, yarı geliştirilmiş olanlardan biraz daha karmaşıktır. Bu tip formüllerde, moleküldeki her bir atomun bağı ve konumu, tüm bileşik temsil edilene kadar Kartezyen bir düzlemde temsil edilir.
Yapısal formül
Yapısal formül, molekülün uzaydaki yapısının grafik bir temsilidir ve bize atomların uzaydaki düzeni ve dağılımı hakkında bilgi verir. Bu formülde molekülü oluşturan kimyasal bağlar da tekli, ikili veya üçlü olup olmadığı gösterilmektedir. Dolayısıyla bu formül bize molekül hakkında en fazla bilgiyi veren formüldür.
Bu tür formüller, kimyasal reaksiyonları veya yeni moleküllerin sentezini çok daha net bir şekilde görmeye izin verdikleri için kimya dünyasında daha profesyonel bir düzeyde kullanılmaktadır.
Lewis formülleri
Bunlar karmaşık, çok özel ve teknik formüllerdir. Ayrıca Lewis diyagramları veya yapıları olarak da bilinirler ve geliştirilmiş molekül formüllerine benzerler, ancak Ek olarak, atomların her bir kimyasal bağda paylaştığı elektronlar, atomların değerliklerine göre değişir. dahil olmuş.
Bu formüllerde, atomlar arasındaki bağlar çizgilerle (tek, çift veya üçlü olduklarını da belirten) veya bir çift nokta ile temsil edilir. Bağda paylaşılmayan yalnız elektronlar veya elektronlar, karşılık geldiği atomun etrafındaki noktalarla temsil edilir.

Resim: Organik Kimya
Formüller yazarken bazenoksidasyon sayısı elementin (iyonik bileşiklerde sık görülür). Bunlar, giden pozitif ve negatif sayılar kümesidir. her elemanla ilişkili.
- Oksidasyon sayıları şu şekilde yorumlanabilir: elektron sayısı bir elementin bir kovalent bağda pay sahibi olması veya bir iyonik bağda transfer olması.
- Atomun üzerindeki oksidasyon işareti olduğunda olumsuz, bu elementin elektronları yakaladığı ve yanında ona eşlik eden sayının yakalanan elektronların sayısı olduğu anlamına gelir. Bu nedenle, -1 oksidasyon durumu, elementin bir elektron, -2'nin iki elektron alması vb. anlamına gelir.
- Oksidasyon işareti olduğunda pozitif, atom bir elektron verir ve bu işarete eşlik eden sayı, verilen elektron sayısıdır. Benzer şekilde, +1'lik bir oksidasyon durumu, bir elektron vermesi, +2'nin iki elektron vermesi vb. anlamına gelir.
Bu çoğunlukla işe yarar iyonik bileşikler, kovalent bağlarda, yorum benzer olsa da, bu bağlar elektronları paylaştığı için aynı değildir. Bu bileşiklerde, elektron çiftinin daha fazlasını çeken ve çektiği elektron sayısına bağlı olarak daha fazla negatif yük bırakan daha elektronegatif elementlerden bahsediyoruz. Bu görülebilir Lewis formülleri.
Kimyasal formüllerin ne için olduğunu bilmek istiyorsanız, bu sayının bazı formülleri elde etmemize izin verdiğini dikkate almalısınız. molekül bilgisi, oldukları gibi:
- NS bağlantı sınıfı Molekül veya bileşiğin atomları arasında oluşur. Bu bağlar, metalik ve metalik olmayan bağlar olmaları durumunda metalik olmayan ve iyonik atomlar katıldığında normal olarak kovalenttir.
- NS moleküler kütle molekülün.
- NS atom sayısı molekülü oluşturan her bir elementin Bazen molekülün yüzdelik bileşimi olarak adlandırılır.
- ifade edilen kütle gram bu, o molekülün bir molüne sahip olacaktı.
İyonik bir bileşik söz konusu olduğunda, örneğin sodyum klorür veya adi tuz, kesinlikle doğru değildir. moleküller hakkında konuşun (bazen yapılır), bunların büyük kümeler oluşturma eğiliminde oldukları ve makro moleküller. Bu durumda bileşiğin formülü, hangi iyonların onu hangi miktarda oluşturduğunu görmemize yardımcı olur.

