Будова та характеристики атома

Зображення: SlidePlayer
Атоми є частиною нашого світу. Вся речовина складається з атомів, тому важливо краще розуміти, з чого вони складаються і які їх функції. У цьому уроці від ВЧИТЕЛЯ ми розповімо вам про що будова атома та характеристики. Якщо ви хочете дізнатись більше про частинки, що складають всю речовину, продовжуйте читати цю статтю.
Індекс
- Що таке атоми?
- Будова атома
- Основні характеристики атома
- Що таке ізотопи?
- Як атоми знаходяться в природі?
Що таке атоми?
атом Це є найменша одиниця, на яку можна поділити речовину не втрачаючи своїх хімічних властивостей, тобто властивостей як хімічного елемента. Атом - це початок усього, що можна побачити чи доторкнутися, починаючи від зірок і закінчуючи вашим сніданком сьогодні вранці.
Якщо відкинути втрату своїх хімічних властивостей, можна сказати, що атом складається з різних частинок, які називаються субатомними частинками. Існує три типи субатомних частинок -протони, нейтрони та електрони- з різними характеристиками.
Ці частинки згруповані в різну кількість для утворення хімічних елементів (кисню, вуглецю тощо), але вони завжди розподілятимуться за фіксованою структурою.

Зображення: Сайти Google
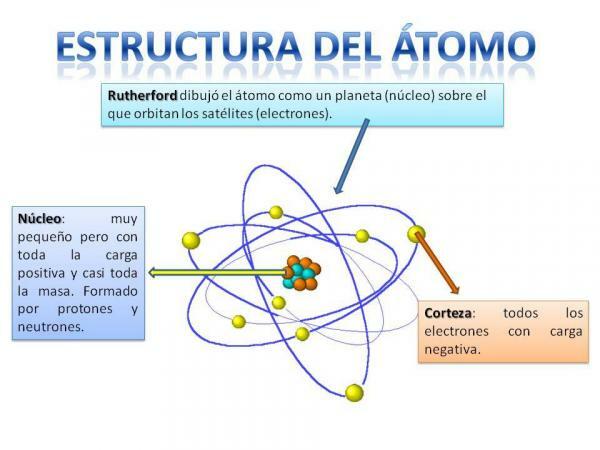
Будова атома.
Будова атома фіксована, тобто ми можемо мати різні типи атомів (атом водню, атом кисню тощо), але їх субатомні частинки завжди організовані подібно до планетарної системи.
Ви точно пам’ятаєте, як влаштована Сонячна система: Сонце знаходиться в центрі та навколо від цього планети обертаються, описуючи різні орбіти, одні ближчі, а інші більш віддалені від Сонце. У випадку з атомами в центрі знаходиться ядро, з формою, подібною до ожини, і складається з нейтрони та протони.
Навколо ядра знаходиться Кортекс яка є площею, через яку електрони. Раніше вважалося, що електрони описують певні орбіти, подібно до того, як це роблять планети, хоча зараз це так знає, що ці орбіти не настільки чітко визначені і вони більше схожі на області, в яких ми, швидше за все, опинимось електрони.
Зображення: REA - План Сейбала
Основні характеристики атома.
Щоб продовжити цей урок про будову атома та характеристики, важливо зосередитись на елементах, які змушують атом вважатись таким.
І для цього ми повинні відповісти на це запитання: Чому всі атоми вирішують впорядкувати себе таким чином? Відповідь проста: це пов’язано з електричні сили притягання. Ядро атома складається з нейтронів, які не мають електричного заряду, і протонів, які мають позитивний електричний заряд. а електрони мають негативний електричний заряд, тому між ядром і електронами існує подібна сила притягання утворюється між двома полюсами магніту, але недостатньо сильний, щоб електрони "впали" до ядро.
Це краще зрозуміти, якщо взяти до уваги розмір ядра: якби атом мав, наприклад, розмір футбольного стадіону, ядро мало б розмір м'яча в центрі з поля Скільки привабливої сили повинен був би зробити футбольний м'яч, щоб на нього впали трибуни стадіону!
Функція нейтронів
Тепер ви можете задатися питанням, і яку роль відіграють нейтрони? Незважаючи на відсутність електричного заряду, нейтрони відіграють велику роль в атомі: вони вносять 99% маси. Якщо це допоможе вам запам’ятати, ми можемо сказати, що атом - це як банда трьох друзів: важкого нейтрон, позитивний протон і негативний електрон, який обертається навколо нейтрона і електрон.
Рух електронів
На цьому етапі я хочу, щоб ми повернулися до чогось, що ми залишили в чорнильниці: до орбіт, які описують електрони навколо ядра. Ми це вже говорили електрони обертаються навколо ядра як роблять планети навколо Сонця, деякі ближче за інші, чому вони це роблять? Електрони обертаються в тій чи іншій оболонці відповідно до енергії, яку вони мають віддалити від ядра, тобто ті електрони, які знаходяться ближче до ядра, не мають достатня сила для віддалення від ядра, тоді як ті, що знаходяться в найвіддаленіших шарах (орбіталях) кори, мають більше енергії і змогли відійти далі від ядра. ядро. Крім того, на кожній з орбіталей є максимальна ємність 8 електронів (правило октету).
Частинки атома
Ми повернемось до іншого підходу, який ми застосовували раніше, але не пояснювали: атоми складаються з нейтрони, протони та електрони, які завжди поєднуються за однаковою структурою ядра та кори, але вони роблять це в різній кількості, утворюючи різні хімічні елементи. Як ми можемо отримати стільки елементів, що поєднують лише 3 типи частинок? Хімічні елементи, які ви коли-небудь бачили, представлені в періодичній системі, характеризуються тим, що мають певний атомний номер.
атомний номер (Z) Він вказує на кількість протонів в ядрі цього типу атомів, яка дорівнює кількості електронів в нормальних умовах. Так, наприклад, усі атоми, що мають 6 протонів (Z = 6), будуть атомами вуглецю, і вони матимуть однакові хімічні властивості; атоми з 5 протонами (Z = 5) будуть атомами бору, з однаковими хімічними властивостями, що відрізняються від атомів вуглецю. Вам не потрібно плутати атомний номер з атомною вагою або масове число (A), що є сумою ваги нейтронів і протонів (вага електронів незначна щодо ваги всього ядра).

Зображення: SlidePlayer
Що таке ізотопи?
У природі ми можемо знайти різні "підтипи" елементів, ізотопи. Я впевнений, що в якийсь момент ви чули про вуглець 14, радіоактивний ізотоп вуглецю, який використовується, серед іншого, за віком скам’янілостей. Ізотопи є два атоми з однаковою кількістю протонів (однаковий атомний номер), але різна кількість нейтронів, (різна атомна маса). Ізотопи одного і того ж елемента зазвичай називають іменем елемента, за яким слідує його атомна маса.
У нашому прикладі обидва ізотопи є вуглецем, тому вони мають атомний номер 6 (Z = 6), але вуглець 12 ("нормальний" вуглець) має атомну масу 12 проти атомної маси вуглецю 14 14. Ізотопи одного і того ж елемента мають дуже схожі хімічні та фізичні властивості. У випадку з вуглецем 14, на відміну від вуглецю 12, це радіоактивний ізотоп, який присутній у всіх елементах, що містять вуглець, включаючи живих істот.
На цьому ми закінчуємо цей урок про будову атома та характеристики. Ми сподіваємось, це допомогло вам.

Зображення: Ваші завдання
Як атоми знаходяться в природі?
Атоми можна знайти ізольовано, але найбільш нормальним є їх пошук об'єднані в групи зателефонував молекули.
Молекули можуть складатися з атомів одного елемента (наприклад, молекули кисню, що складається з двох атомів кисню) або групами з атомами різних елементів (два атоми водню і один кисню утворюють молекулу Води). Ці групи елементів називаються молекулами, які в свою чергу можуть поєднуватися між собою і утворюючи різні дедалі складніші угруповання відповідно до їх реакційної здатності та хімічної спорідненості до джерело хімічні зв’язки.
Якщо ви хочете прочитати більше статей, подібних до Будова та характеристики атома, рекомендуємо ввести нашу категорію Атом.
