10 типів хімічних зв’язків (пояснені на прикладах)
Хімічні зв’язки є сили, що утримують атоми разом утворювати молекули. Існує три типи зв’язків між атомами:
- Металевий зв’язок.
- Іонний зв’язок.
- Ковалентний зв’язок: неполярний, полярний, простий, подвійний, потрійний, дативний.
Завдяки цим зв’язкам утворюються всі сполуки, що існують у природі. Існують також сили, що утримують молекули разом, відомі як міжмолекулярні зв’язки, такі як:
- Водневі зв’язки або мости.
- Диполь-дипольні сили.
Далі ми пояснюємо кожне з цих посилань.
| Види хімічного зв’язку | Характерний | Приклади | |
|---|---|---|---|
| Металеві | Іони металу плавають у морі рухомих електронів. | Металеві елементи: натрій, барій, срібло, залізо, мідь. | |
| Іонний | Перенесення електронів від одного атома до іншого. | Na хлорид натрію+Кл- | |
| Ковалентний | Неполярний | Поділяють електрони порівну між двома атомами. | Молекулярний водень H-H або H2 |
| Полярний | Поділяють електрони нерівномірно між двома атомами. | Молекула води Н2АБО | |
| Простий | Поділіться парою електронів. | Молекула хлору Cl2 Cl-Cl | |
| Подвійний | Поділіться двома парами електронів. | Молекула кисню O2 O = O | |
| Потрійний | Поділіться трьома парами електронів. | Молекула азоту N≣N або N2 | |
| Датив | Лише один з атомів поділяє електрони. | Зв’язок між азотом та бором у сполуці аміак-бор трифториду. | |
| Міжмолекулярні сили | Водневий міст | Гідрогени однієї молекули притягуються до електронегативних атомів іншої молекули. | Водневі зв’язки між воднем в одній молекулі води з киснем в іншій молекулі води. |
| Диполь-диполь | Молекули з двома електричними полюсами притягують протилежні полюси інших молекул. | Взаємодія між молекулами Н метану2C = O |
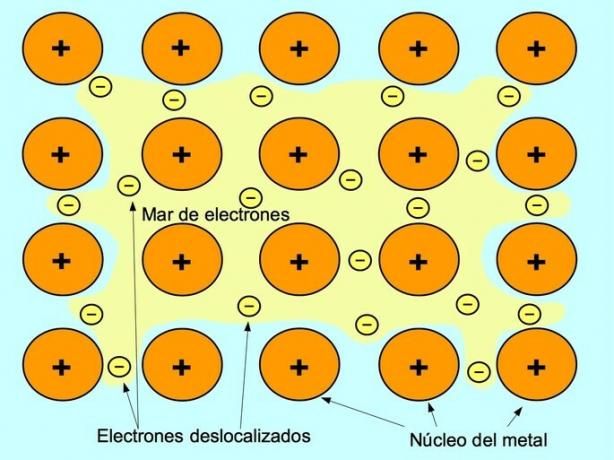
Металевий зв’язок
Металевий зв’язок - це сила притягання між позитивними іонами металевих елементів та негативними електронами, що вільно рухаються між іонами. Атоми металів щільно упаковані, це дозволяє електронам рухатися всередині решітки атомів.
У металах валентні електрони звільняються від свого початкового атома і утворюють "море" електронів, яке плаває навколо всієї металевої структури. Це призводить до того, що атоми металів перетворюються на позитивно заряджені іони металів, які упаковуються між собою.
Металевий зв’язок встановлюється між такими металевими елементами, як натрій Na, барій Ba, кальцій Ca, магній Mg, золото Au, срібло Ag та алюміній Al.
Іонний зв’язок
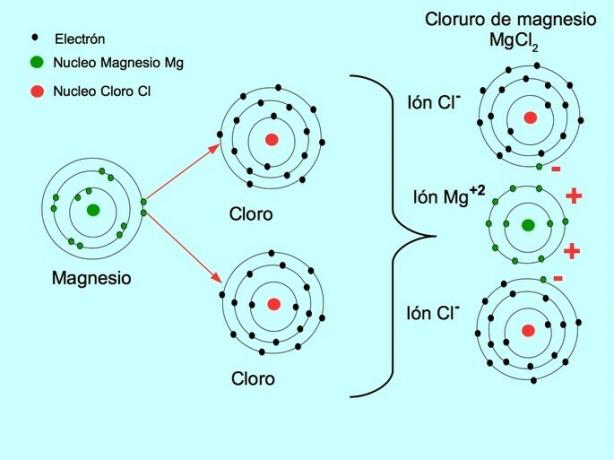
Іонний зв’язок - це сила, яка з’єднує металевий елемент, такий як натрій або магній, з неметалевим елементом, таким як хлор або сірка. Метал втрачає електрони і перетворюється на позитивний іон металу, який називається катіон. Ці електрони переходять до неметалевого елемента, і він перетворюється в негативно заряджений іон аніон.
Катіони та аніони поєднуються і утворюють тривимірну мережу, яка підтримується силами електростатичного притягання між іонами з різними зарядами. Ці сили утворюють іонні сполуки.
Земна кора складається переважно з іонних сполук. Більшість гірських порід, мінералів та дорогоцінних каменів є іонними сполуками. Наприклад:
- Хлорид натрію NaCl: металевим елементом є натрій, який переносить електрон до хлору, який є неметалевим елементом.
- Хлорид магнію MgCl2: Магній магній віддає два електрони на два атоми хлору, як показано на малюнку нижче:
Дивитися також Різниця між катіонами та аніонами.
Ковалентний зв’язок
Ковалентний зв’язок утворюється, коли два неметалеві атоми ділять електрони. Цей зв’язок може бути декількох типів залежно від спорідненості до електронів атомів і кількості спільних електронів.
Неполярний ковалентний зв’язок
Неполярний ковалентний зв’язок - це зв’язок, який утворюється між двома атомами, де електрони розподіляються порівну. Цей зв’язок зазвичай відбувається в симетричних молекулах, тобто молекулах, що складаються з двох рівних атомів, таких як молекула водню H2 і молекула кисню O2.

Полярний ковалентний зв’язок
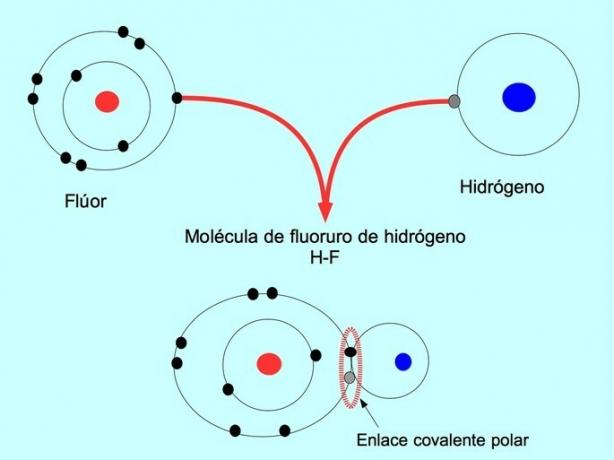
Полярний ковалентний зв’язок утворюється, коли два атоми ділять електрони, але один з них має більший потяг до електронів. Це робить молекулу більш негативним "полюсом" з більшою кількістю електронів, а протилежний полюс є більш позитивним.
Молекули з таким розподілом або дисбалансом електронів відомі як полярні. Наприклад, у фтористому водню HF існує ковалентний зв’язок між воднем і фтором, але фтор має вищу електронегативність, тому він сильніше притягує електрони поділилися.
Простий ковалентний зв’язок
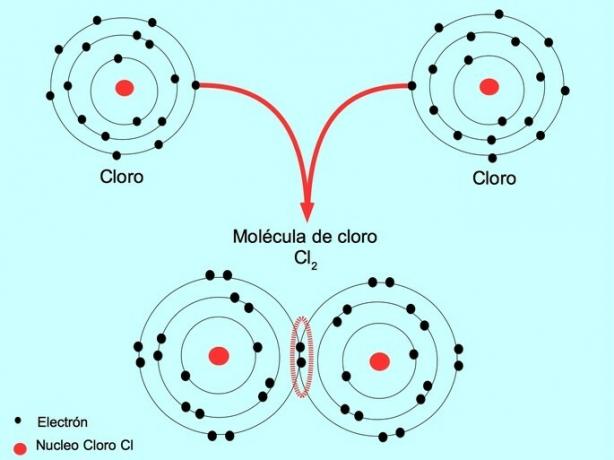
Коли два атоми ділять два електрони, по одному від кожного, утворений ковалентний зв’язок називається простим ковалентним зв’язком.
Наприклад, хлор - це атом, у зовнішній оболонці якого є сім валентних електронів, який може бути заповнений вісьмома електронами. Хлор може поєднуватися з іншим хлором, утворюючи молекулу хлору Cl2 який є набагато стабільнішим, ніж лише хлор.
Подвійний ковалентний зв’язок
Подвійний ковалентний зв’язок - це зв’язок, де чотири електрони (дві пари) електронів діляться між двома атомами. Наприклад, кисень має 6 електронів в останній оболонці. Коли два кисню поєднуються, чотири електрони діляться між собою, в результаті чого кожен має 8 електронів в останній оболонці.
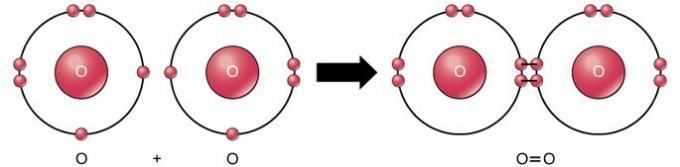
Потрійний ковалентний зв’язок
Потрійний ковалентний зв’язок утворюється, коли між двома атомами ділиться 6 електронів (або три пари). Наприклад, у молекулі ціаністого водню HCN утворюється потрійний зв’язок між вуглецем та азотом, як показано на малюнку нижче:
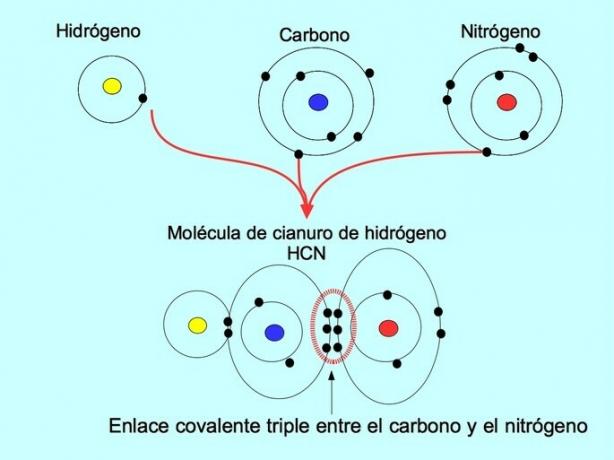
Координатний або дативний ковалентний зв’язок
Координований або дативний ковалентний зв’язок - це зв’язок, який утворюється, коли лише один з атомів зв’язку вносить пару електронів. Наприклад, коли аміак NH реагує3 з трифторидом бору BF3, Азот зв’язується з двома електронами безпосередньо з бором, у якого немає електронів, доступних для спільного використання. Таким чином, і азот, і бор залишаються з 8 електронами у валентній оболонці.
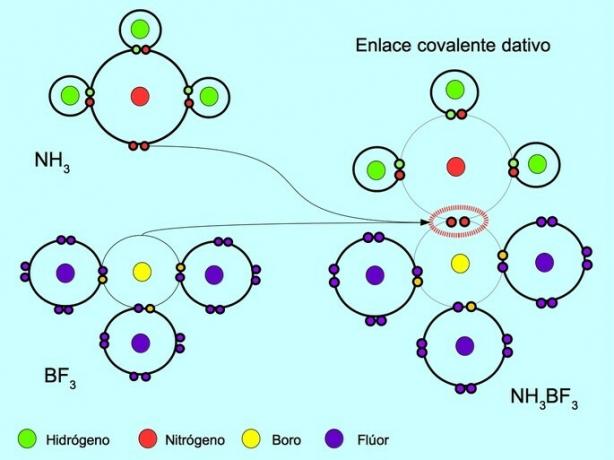
Дивитися також Органічні та неорганічні сполуки.
Міжмолекулярні зв’язки
Молекули асоціюються через сили, що дозволяють утворювати речовини в рідкому або твердому стані.
Диполь-дипольні зв’язки або сили
Слабкі міжмолекулярні зв’язки можуть встановлюватися між полярними молекулами, коли негативні полюси притягуються до позитивних полюсів, і навпаки. Наприклад, метанал H2C = O - полярна молекула з частковим негативним зарядом на кисні та частково позитивним зарядом на воднях. Позитивна сторона однієї молекули метану приваблює негативну сторону іншої молекули метану.
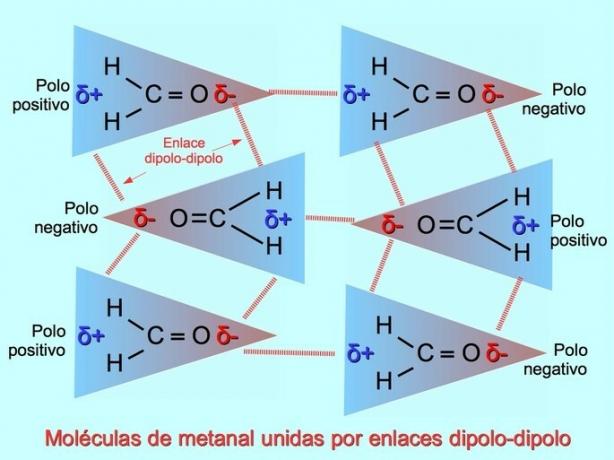
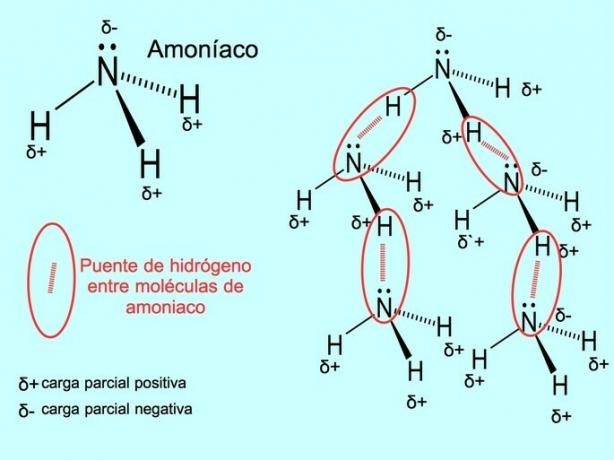
Водневі зв’язки або зв’язки
Водневий зв’язок або водневий зв’язок - це зв’язок, який встановлюється між молекулами. Це відбувається, коли водень у молекулі ковалентно зв’язаний з киснем, азотом або фтором. Кисень, азот та фтор є атомами з вищою електронегативністю, тому вони сильніше притягують електрони, коли ділять їх з іншим менш електронегативним атомом.
Між молекулами води H існують водневі зв’язки2O і аміак NH3 як показано на малюнку:
Можливо, вам буде цікаво переглянути:
- Атоми та молекули.
- Приклади органічних та неорганічних сполук.
- Метали та неметали
Список літератури
Зумдал, С.С., Зумдал, С.А. (2014) Хімія. Дев’яте видання. Брукс / Коул. Белмонт.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5-е видання. Пірсон, Австралія. Мельбурн.


