Характеристика кислот і основ: основні відмінності
Характеристики кислот і основ - це всі ті властивості та якості, за якими ми можемо розрізнити кислоту та основу.
Згідно з теорією Арреніуса, a кислота є речовиною, яка виділяє протони Н+ при розчиненні у воді, а база - це будь-яка речовина, що виділяє гідроксильні іони OH- у водному розчині.
| Кислоти | Основи | |
|---|---|---|
| Утворення іонів | Присутні | Присутні |
| Реакція нейтралізації | Коли він реагує з основою. | Коли він реагує з кислотою. |
| Розчинність у воді | Розчинний | Частково розчинний. Гідроксиди кальцію, барію та алюмінію погано розчиняються. |
| Електропровідність | Присутні | Присутні |
| Стан речовини | Твердий, рідкий або газоподібний | Твердий, рідкий або газоподібний |
| Реакція з лакмусовим папером | Червоне забарвлення | Синє забарвлення |
| Значення PH | До 7 років | Більше 7 |
| Спряжений відповідник | Слабка кислота утворює кон'юговану основу. | Слабка основа утворює кон'юговану кислоту. |
| Корозійний ефект | Сильні кислоти | Міцні основи |
Характеристика кислот
Кислоти мають кілька характеристик, за якими їх можна ідентифікувати.
Здатність утворювати іони з кислот
Основною характеристикою кислих речовин є те, що вони можуть іонізуватися, тобто втрачати або отримувати електрони.
Соляна кислота HCl, сильна кислота, іонізується, утворюючи хлористий аніон Cl- і протон H+.
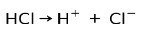
Реакція нейтралізації
Кислота реагує з основою, утворюючи сіль і воду. Ця реакція відома як реакція нейтралізації. Наприклад, HCl реагує з NaOH, утворюючи хлорид натрію NaCl (кухонна сіль) і вода:
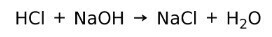
Розчинність у воді кислот
Кислоти, як правило, розчиняються у воді. Наприклад, соляна кислота або сольова кислота помірно розчиняються у воді, до 82 г HCl можна розчинити в 100 мл води при 0ºC. У разі сірчаної кислоти Н2SW4, суміш з водою генерує тепло, тому завжди бажано додавати кислоту у воду, щоб уникнути вибухів.
Кислотна сила
Те, як кислоти дисоціюють, визначає, сильні вони чи слабкі. Сила кислоти надається її константа дисоціації.
Азотна кислота HNO3 це сильна кислота оскільки у водному розчині він повністю іонізується в протони та нітрат-іони:

Це означає, що коли ми додаємо HNO3 у воді, при аналізі води ми знайдемо лише Н+ і нітрат-іони, і практично відсутні HNO3.
Натомість оцтова кислота, яка міститься в оцті, є слабка кислота, оскільки лише частина її роз'єднана:
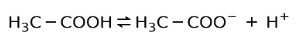
Ось чому він представлений стрілками у двох напрямках, це означає, що у водному розчині ми матимемо оцтову кислоту, H+ і ацетатний аніон (H3C-COO-).
Стани речовин кислот
Кислоти можуть знаходитись у рідкому, твердому або газоподібному стані. Наприклад, соляна кислота HCl - це рідина, сірководень HS - газ, а щавлева кислота - тверда речовина.
Реакція з лакмусовим папером від кислот

Коли ми поміщаємо смужку лакмусового паперу в кислу речовину, лакмусовий папір стає червоним.
Ідентифікація кислот за їх рН
РН - міра кількості Н+ присутній у розчині. Таким чином, між рН 0 і 7 ми знаходимось у присутності кислоти. Наприклад, рН оцту дорівнює 2, рН сірчаної кислоти в автомобільних акумуляторах дорівнює 1.
Електропровідність кислот
Оскільки кислоти можуть дисоціювати та виробляти електрично заряджені іони, кислі розчини можуть проводити електрику. Наприклад, всередині автомобільних акумуляторів сірчана кислота, яка є сильною кислотою, використовується як провідник електрики.
Корозійний ефект сильних кислот
Сильні кислоти мають корозійну дію, вони можуть спалити органічні тканини, тому поводження з ними повинно бути надзвичайно обережним.
Слабкі кислоти утворюють спряжений аналог
При розчиненні слабкі кислоти утворюють так звану пару кон’югатів, тобто слабка кислота утворює кон’югат основи.
Наприклад:

У цьому випадку мурашина або метанова кислота (HCOOH) при дисоціації утворює кон'югований формат іонів основи.
Це може вас зацікавити:
- Сильні та слабкі кислоти та основи.
- Приклади кислот та основ.
Характеристика основ
Далі ми представляємо властивості основ або лужних розчинів, що їх характеризують.
Базова іонізаційна здатність
Основні або лужні речовини характеризуються утворенням іонів при розчиненні у воді:

У цьому випадку гідроксид натрію NaOH іонізується, утворюючи гідроксид-аніон OH- і катіон натрію Na+.
Основа реагує з кислотою, утворюючи сіль
Основа реагує з кислотою в реакції нейтралізації, утворюючи воду та сіль, наприклад:

У цьому випадку гідроксид алюмінію Al (OH)3, основа, реагує з HCl і утворює хлорид алюмінію сіль AlCl3 і води. Гідроксид алюмінію використовується як антацид для полегшення шлункового рефлюксу шляхом нейтралізації кислоти, що виробляється шлунком.
Основи розчинності у воді
Деякі основи розчиняються у воді. Лужноземельні гідроксиди, такі як гідроксид кальцію та гідроксид барію, погано розчиняються у воді. Наприклад, гідроксид натрію або їдкий натр можна розчинити 109 г у 100 мл води при 20ºC. При цьому гідроксид магнію або молоко магнезії Mg (OH)2 він практично не розчиняється у воді.
Міцність основи
Залежно від ступеня іонізації основи, вони можуть бути сильними або слабкими. Наприклад, гідроксид літію є міцна основа оскільки у водному розчині він повністю іонізується в гідроксид-іони OH та катіони Li літію+:
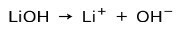
З іншого боку, аміак NH3 є слабка база оскільки при контакті з водою не весь аміак дисоціює:
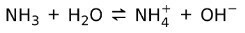
Стан справи основ
Основи можна знайти у твердому, рідкому та газоподібному станах. Наприклад, чистий гідроксид натрію твердий, аміак - газ.
Реакція з лакмусовим папером основ
Коли ми поміщаємо смужку лакмусового паперу в лужну речовину, папір стає синім.
Ідентифікація основ за їх рН
Основи характеризуються тим, що мають рН від 7 до 14.
 Електропровідність основ
Електропровідність основ
Основи завдяки своїй іонізаційній здатності є хорошими провідниками електрики. Наприклад, у лужних батареях гідроксид калію КОН використовується як електричний провідник.
Корозійний ефект основ
Сильні основи можуть пошкодити органічні тканини. Наприклад, засоби для чищення кухонних духовок, як правило, є міцною основою, і завжди рекомендується поводитися з ними з особливою обережністю, одягаючи рукавички та засоби захисту очей.
Слабкі основи утворюють спряжений відповідник
Слабкі основи при розчиненні утворюють кон'югований аналог, тобто слабка основа утворює кон'юговану кислоту.
Наприклад, трис- (гідроксиметил) амінометан (OHCH2)3CNH2 є слабкою основою, кон'югована кислота якої (OHCH2)3CNH3+:
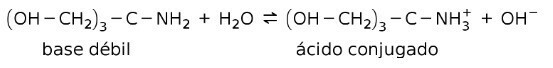
Це основа дії буферних речовин або буфер, які є речовинами, які використовуються для постійного підтримання рН розчинів.
Можливо, вам буде цікаво дізнатися різницю між:
- Кислоти та основи.
- Катіони та аніони