تعريف الأيونات الموجبة أو السلبية

كما نعلم بالفعل ، ذرات يتم تشكيلها من قبل الجسيمات دون الذرية. من بين الأنواع الثلاثة للجسيمات دون الذرية ، ليس للنيوترونات سوى شحنة كهربائية. بدلاً من ذلك ، تمتلك البروتونات شحنة كهربائية موجبة بينما للإلكترونات شحنة سالبة. يمكن فقط نقل الإلكترونات ، التي تشغل محيط الذرة ، من ذرة إلى أخرى ، بينما تحافظ البروتونات في النواة على ثبات عددها. في هذا الدرس من المعلم سنرى ما يحدث عندما تكتسب الذرات أو الجزيئات الإلكترونات أو تفقدها. هذا هو ، سوف نرى تعريف وأمثلة الأيونات الموجبة أو السالبة.
فهرس
- ما هي الايونات؟ تعريف سهل
- تشكيل الأيونات: الانجذاب الكهربائي و الكهربية
- ما هي الأيونات السالبة؟ مع الأمثلة
- ما هي الأيونات الموجبة؟ مع الأمثلة
ما هي الايونات؟ تعريف سهل.
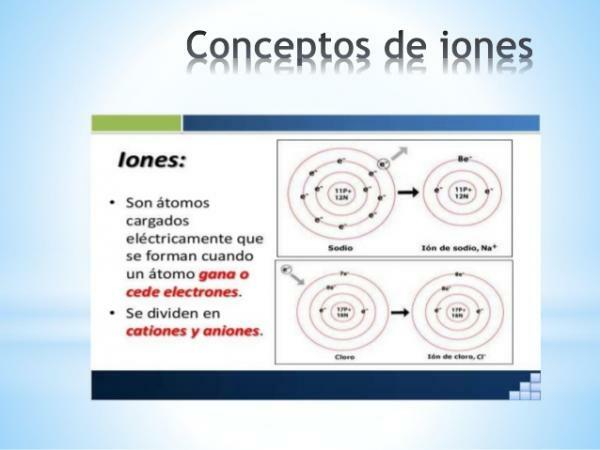
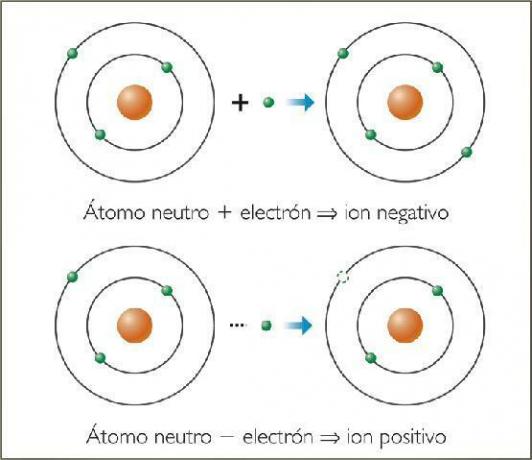
أ أيون أي ذرة أو جزيء بشحنة كهربائية صافية. أي أنها ذرة أو مجموعة ذرات مرتبطة ببعضها البعض وشحناتها الكهربائية لا يتم تعويضهم. يحدث هذا التعويض عن الشحنات عندما ينضم إلكترون واحد أو أكثر أو يترك ذرة أو مجموعة من الذرات.
وهكذا تكون الأيونات الذرات أو الجزيئات المشحونة ، بسبب اكتساب أو فقدان الإلكترونات (جسيمات دون ذرية ذات شحنة سالبة وكتلة ضئيلة).
أنواع الأيونات: أحادي الذرة ومتعدد الذرات
إذا أخذنا في الاعتبار تكوين الأيونات ، يتم تمييز نوعين: أيونات أحادية الذرة وأيونات متعددة الذرات.
- حسب الاسم المقترح، أيونات أحادية الذرة تلك التي تم تشكيلها من قبل ذرة واحدة.
- المركبات الأيونية o أيونات متعدد الذرات هي تلك التي ترتبط فيها الذرات تساهميًا (تشارك زوجًا واحدًا أو أكثر من الإلكترونات في الرابطة) تقدم عددًا من النيوترونات في الجزيء يختلف عن العدد الإجمالي للإلكترونات.
- ال أيونات متعدد الذرات تحتوي عادة الأكسجين وعادة ما يكون لها بنية ذات ذرة مركزية يتم ترتيب العناصر المتبقية التي يتكون منها الجزيء حولها.
- ال شحنة الأيونات أحادية الذرة من العناصر التمثيلية (العائلات 1 و 2 من الجدول والعائلات من 13 إلى 17 من الجدول الدوري) يمكن استنتاجها بسهولة إذا كان موقعها ضمن الجدول الدوري معروفًا. في هذه الحالات ، تكتسب الذرات إلكترونات أو تفقدها من أجل الوصول ، في غلاف التكافؤ ، إلى تكوين الغاز النبيل في تلك الفترة (س2ص6) ، أو ما هو نفسه ، استيفاء القاعدة الثماني.
الصورة: Slideshare
تشكيل الأيونات: الانجذاب الكهربائي و الكهربية.
قدرة الذرات أو الجزيئات على شكل الأيونات يتم تحديده من خلال خاصيتين دوريتين: الانجذاب الكهربائي والكهرباء. تزداد قيمة كلتا الخاصيتين على مدار فترة وتنقصان عندما ننزل من خلال مجموعة أو عائلة من الجدول الدوري.
ال الانجذاب الكهربائيتُعرف أيضًا باسم تقارب الإلكترون ، وهي خاصية ذرية تُعرّف على أنها قدرة الذرة على جذب الإلكترونات. في حالة المركبات ، تسمى خاصية مماثلة كهرسلبية والتي تعرف بأنها قدرة الذرة على جذب الإلكترونات عندما تشكل رابطة مع ذرة أخرى. وهكذا تحدد كلتا الخاصيتين ميل عنصر ما لالتقاط الإلكترونات أو فقدها.
الرابطة الأيونية
في شكلها الصلب ، تشكل الأيونات مركبات أو بلورات أيونية (أملاح) ، تتكون من مزيج من أيونات علامة مختلفة مرتبطة ببعضها البعض عن طريق الرابطة الأيونية. أفضل مثال معروف لهذا النوع من المركبات هو الملح الشائع (كلوريد الصوديوم: كلوريد الصوديوم).
تتكون الرابطة الأيونية من اتحادات أيونات ذات إشارات مختلفة عن طريق قوى الجذب الكهروستاتيكية (التجاذب بين شحنات الإشارة المعاكسة). العناصر التي تختلف كهربيتها الكهربية أو تقاربها الكهربائي (العناصر المعدنية وغير المعدنية) في هذا النوع من الروابط. في معظم الحالات ، تكون هذه المركبات الأيونية يذوب في الماء والمذيبات القطبية الأخرى.
في المحاليل المائية ، تنفصل المركبات الأيونية إلى أيونات حرة تسمى الشوارد، لأن وجوده في المحلول يجعل الماء يتصرف كموصل كهربائي.
ما هي الأيونات السالبة؟ مع الأمثلة.
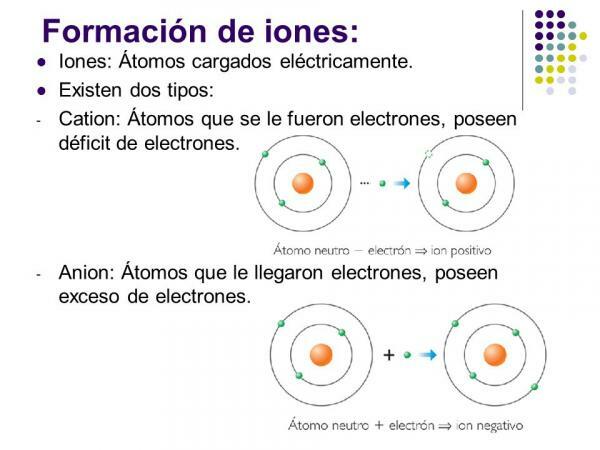
ال الأيونات السالبة يطلق عليهم الأنيونات. وهي في جميع الأحوال ذرات عناصر غير فلزية أو جزيئات تحتوي على عناصر غير معدنية. تتميز هذه العناصر بوجود تقارب كهربائي كبير وسلبية كهربائية. بمعنى آخر ، إنها أيونات تتكون من عناصر ذات ميل كبير لالتقاط الإلكترونات.
الأنيونات أحادية الذرة: التعريف والأمثلة
هي الأنيونات المكونة من ذرات العناصر غير المعدنية (المجموعات من 13 إلى 17 من الجدول الدوري) ، والتي اكتسبت إلكترونًا واحدًا أو أكثر. تشترك هذه الأنيونات في التركيب (الهياكل الإلكترونية للغازات النبيلة)2ص6) في غلافه الإلكتروني الخارجي (غلاف التكافؤ).
أمثلة:
- أيون الكلوريد: Cl-
- أيون الفلوريد: F-
- يوديد أيون:-
- أيون الكبريتيد: S.-2
- أيون النيتريد: N-3
الأنيونات متعددة الذرات: التعريف والأمثلة
وهي عبارة عن أيونات سالبة الشحنة تتكون من ذرتين أو أكثر من العناصر غير المعدنية المرتبطة بروابط تساهمية. هم الأيونات متعددة الذرات الأكثر شيوعًا. أكثر الأنيونات متعددة الذرات شيوعًا هي الأكسوان ، والتي تتكون من ذرة مركزية غير معدنية وتحتوي على الأكسجين.
بشكل عام ، تعتبر مركبات كيميائية يتم الحصول عليها عندما يفقد مركب حمضي واحدًا أو أكثر من البروتونات (H+). يمكن لهذه الأنيونات متعددة الذرات الاحتفاظ ببعض الهيدروجين في بنيتها ، مما يمنحها سمة حمضية معينة (القدرة على التخلي عن البروتونات).
أمثلة:
- أيون النترات: NO3-
- أيون البرمنجنات: MnO4-
- أيون الفوسفات: PO4-3
- كربونات الهيدروجين أو أيون البيكربونات: HCO3-
- أيون الكبريتيت: SO3-2
الصورة: Naturopathy
ما هي الأيونات الموجبة؟ مع الأمثلة.
تسمى الأيونات الموجبة جations. في جميع الحالات تقريبًا ، تكون ذرات عناصر معدنية أو جزيئات تحتوي على عناصر معدنية. تتميز هذه العناصر بانخفاض شديد في التقارب الكهربائي والسلبية الكهربية ، وهذا هو السبب في أنها تظهر ميلًا واضحًا لفقد الإلكترونات.
الكاتيونات أحادية الذرة: التعريف والأمثلة
إنها أيونات موجبة الشحنة (بسبب فقدان الإلكترونات) تتكون من ذرة واحدة من عنصر فلزي. في هذه الحالة ، يتشكل الكاتيون بفقدان الإلكترونات التي تسمح للعنصر بإفراغ الطبقة الإلكترونية الخارجية والحصول على تكوين الغازات النبيلة.2ص6) من المستوى الأدنى. هم النوع الأكثر شيوعًا من الكاتيون.
أمثلة:
- هيدروجين أو كاتيون هيدرون (يسمى أيضًا بروتون): H+
- كاتيون الصوديوم: Na+
- كاتيون الحديد (III) أو كاتيون الحديديك: Fe+3
- كاتيون الكالسيوم: Ca+2
- النحاس (II) أو الكاتيون النحاسي: Cu+2
الكاتيونات متعددة الذرات: التعريف والأمثلة
الكاتيونات متعددة الذرات هي تلك التي تتكون من ذرتين أو أكثر. وهي نادرة ، وأكثرها وفرة هي ما يسمى الكاتيونات المتجانسة وهي تلك التي تحتوي على أكثر من واحد ذرة من نفس العنصر ، في حالة أيون ثلاثي الهيدروجين ، فهي واحدة من أكثر الجزيئات وفرة في كون. الكاتيونات متعددة الذرات المكونة من ذرات عناصر مختلفة ليست شائعة ولكنها تتميز بها يعتبر وجود الهيدروجين ناشئًا عندما يلتقط المركب الأساسي بروتونًا (ح+).
أمثلة:
- كاتيون الأمونيوم: NH4+
- كاتيون أوكسونيوم: HO3+
- كاتيون الفوسفونيوم: PH3+
- ثلاثي الهيدروجين الكاتيون أو الهيدروجين الجزيئي البروتوني: H3+
- ثنائي الزئبق الموجبة: Hg2+2
الصورة: الكواكب
إذا كنت ترغب في قراءة المزيد من المقالات المشابهة لـ الأيونات السالبة والموجبة: التعريف والأمثلة، نوصيك بإدخال فئة الذرة.
فهرس
أليخاندرينا جاليجو بيكو ، روزا مو جارسينيو مارتينيز ، مو خوسيه مورسيلو أورتيجا ، ميغيل أنجيل فاسكيز سيغورا. (2018) الكيمياء الأساسية. مدريد: Uned