Структура на атома и характеристики

Изображение: SlidePlayer
Атомите са част от нашия свят. Цялата материя е изградена от атоми, затова е важно да се разбере по-добре от какво се състоят и какви са техните функции. В този урок от УЧИТЕЛ ще ви кажем какво структура на атом и характеристики. Ако искате да научите повече за частиците, които съставляват цялата материя, продължете да четете тази статия.
Индекс
- Какво представляват атомите?
- Структура на атома
- Основни характеристики на атома
- Какво представляват изотопите?
- Как се намират атомите в природата?
Какво представляват атомите?
The атом то е най-малката единица, на която материята може да бъде разделена без да губи своите химични свойства, тоест свойствата си като химичен елемент. Атомът е началото на всичко, което може да се види или докосне, от звездите до закуската ви тази сутрин.
Ако оставим настрана загубата на химичните му свойства, можем да кажем, че атомът е изграден от различни частици, наречени субатомни частици. Има три вида субатомни частици -протони, неутрони и електрони- с различни характеристики.
Тези частици са групирани в различен брой, за да образуват химичните елементи (кислород, въглерод и др.), Но те винаги ще бъдат разпределени след фиксирана структура.

Изображение: Google Sites
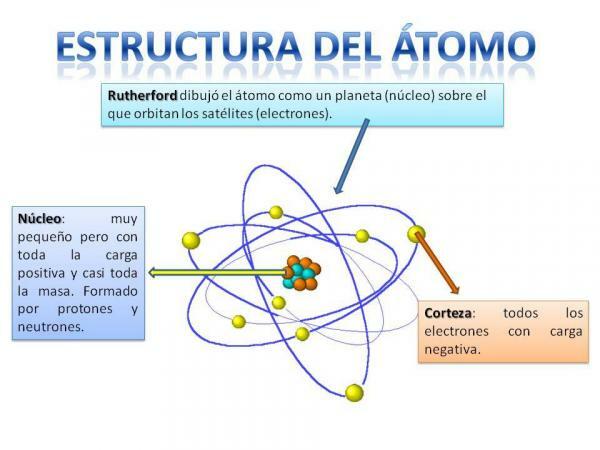
Структура на атома.
Структурата на атома е фиксирана, тоест можем да имаме различни видове атоми (водородния атом, кислородния атом и т.н.), но техните субатомни частици винаги са организирани по подобен начин на планетарната система.
Със сигурност ще запомните как е организирана Слънчевата система: Слънцето е в центъра и наоколо от това планетите се въртят, описвайки различни орбити, някои по-близо и други по-отдалечени от Слънце. В случай на атоми, в центъра е ядро, с форма, подобна на къпина и е съставена от неутрони и протони.
Около ядрото е Кортекс което е областта, през която електрони. По-рано се смяташе, че електроните описват определени орбити, подобно на това, което правят планетите, въпреки че сега е така знае, че тези орбити не са толкова добре дефинирани и са по-скоро като области, в които е по-вероятно да се озовем електрони.
Изображение: REA - План на Ceibal
Основни характеристики на атома.
За да продължите с този урок за структурата на атома и характеристиките, е важно да се съсредоточите върху елементите, които карат атома да се счита за такъв.
И за това трябва да отговорим на този въпрос: Защо всички атоми решават да се подредят по този определен начин? Отговорът е прост: дължи се на електрически атрактивни сили. Ядрото на атома се състои от неутрони, които нямат електрически заряд, и протони, които имат положителен електрически заряд. а електроните имат отрицателен електрически заряд, така че има подобна сила на привличане между ядрото и електроните произведен между двата полюса на магнит, но не е достатъчно силен, за да могат електроните да "паднат" до ядро.
Това се разбира по-добре, ако вземем предвид размер на ядрото: ако атомът имаше например размера на футболен стадион, ядрото би имало размера на топката в центъра от полето Колко привлекателна сила ще трябва да направи футболната топка, за да паднат върху нея трибуните на стадиона!
Функцията на неутроните
Сега може би се чудите и каква роля играят неутроните? Въпреки че нямат електрически заряд, неутроните имат голяма роля в атома: те допринасят 99% от масата. Ако ви помага да запомните, можем да кажем, че атомът е като банда от трима приятели: тежката неутрон, положителният протон и отрицателният електрон, който обикаля и закръгля неутрон и електрон.
Движението на електроните
В този момент искам да се върнем към нещо, което бяхме оставили в мастилницата: орбитите, които електроните описват около ядрото. Ние го бяхме казали електроните се въртят около ядрото Както правят планетите около Слънцето, някои по-близо от други, защо го правят? Електроните се въртят в една или друга обвивка в зависимост от енергията, която трябва да се отдалечат от ядрото, т.е. тези електрони, които са по-близо до ядрото, нямат достатъчна сила за отдалечаване от ядрото, докато тези в най-отдалечените слоеве (орбитали) на кората имат повече енергия и са успели да се отдалечат по-далеч от ядрото. ядро. Освен това във всяка от орбиталите има максимален капацитет от 8 електрона (правило на октет).
Частиците на атом
Ще се върнем към друг подход, който сме правили преди, но не сме обяснявали: атомите са съставени неутрони, протони и електрони, които винаги се комбинират, следвайки една и съща структура на ядрото и кората, но те го правят в различен брой, за да образуват различните химични елементи. Как можем да получим толкова много елементи, съчетаващи само 3 вида частици? Химическите елементи, които някога сте виждали представени в периодичната таблица, се характеризират с наличието на определен атомен номер.
The атомен номер (Z) Той показва броя на протоните в ядрото на този тип атоми, което е равно на броя на електроните при нормални условия. Така, например, всички атоми, които имат 6 протона (Z = 6), ще бъдат въглеродни атоми и те ще имат същите химични свойства; атомите с 5 протона (Z = 5) ще бъдат борни атоми, със същите химични свойства като всеки друг и различни от тези на въглеродните атоми. Не е нужно да бъркате атомно число с атомно тегло или масово число (A), което е сумата от теглото на неутроните и протоните (теглото на електроните е незначително по отношение на теглото на общото ядро).

Изображение: SlidePlayer
Какво представляват изотопите?
В природата можем да намерим различни "подтипове" на елементите, изотопи. Сигурен съм, че в даден момент сте чували за въглерод 14, радиоактивен изотоп на въглерода, който се използва, наред с други неща, възрастта на вкаменелостите. Изотопите са два атома с еднакъв брой протони (един и същ атомен номер), но различен брой неутрони, (различна атомна маса). Изотопите на същия елемент обикновено се именуват с името на елемента, последвано от атомната му маса.
В нашия пример и двата изотопа са въглерод, така че имат атомен номер 6 (Z = 6), но въглерод 12 („нормален“ въглерод) има атомно тегло 12 спрямо атомното тегло на въглерод 14 14. Изотопите на един и същи елемент имат много сходни химични и физични свойства. В случая на въглерод 14, за разлика от въглерод 12, това е радиоактивен изотоп, който присъства във всички елементи, съдържащи въглерод, включително живите същества.
И с това завършваме този урок за структурата на атома и характеристиките. Надяваме се, че ви е помогнал.

Изображение: Вашите задачи
Как се намират атомите в природата?
Атомите могат да бъдат намерени изолирано, но най-нормалното е да ги намерите комбинирани в групи Наречен молекули.
Молекулите могат да се състоят от атоми на един и същ елемент (като кислородната молекула, съставена от два атома на кислород) или от групи с атоми на различни елементи (два атома водород и един кислород образуват молекулата на Вода). Тези групи елементи се наричат молекули, които от своя страна могат да се комбинират помежду си и образувайки различни все по-сложни групировки според тяхната реактивност и техния химичен афинитет към източник на химически връзки.
Ако искате да прочетете повече статии, подобни на Структура на атома и характеристики, препоръчваме да въведете нашата категория на Атомът.