10 typů chemických prvků (vysvětleno a klasifikováno)
Kolik chemických prvků musí existovat ve vesmíru? Tato otázka má ještě dlouhou cestu, protože vědci čas od času vytvářejí vlastní umělé chemické prvky.
Na co však můžeme odpovědět, je kolik typů chemických prvků musí existovat, něco, co se dozvíme příště.
- Související článek: „11 typů chemických reakcí“
Druhy chemických prvků
V přírodě najdeme všechny druhy látek. Tyto látky se obvykle nenacházejí v čistém stavu, ale jsou výsledkem kombinace různých prvky nebo materiály, které v důsledku různých reakcí, procesů a časových období vedly ke vzniku všech druhů hmota. Ve vesmíru neexistuje nic, co by nebylo výsledkem kombinace atomů patřících k různým typům chemických prvků, které uvidíme do hloubky.
Než se však podíváme na typy chemických prvků, udělejme si malý přehled středoškolské vědy a připomeňme si, jaké chemické prvky to jsou.
Říkáme hmotě „chemického prvku“, která je složena ze stejného typu atomu, tj. Z látky, která je atomově čistá. Chemické prvky nelze rozložit na jednodušší a zařazují se do periodické tabulky prvků jako čistých materiálů vesmíru.
Ale pozor! Nesmíme zaměňovat prvky s jednoduchými látkami, protože v určitých případech mohou skládat dva nebo více atomů stejného prvku molekuly seskupené různými způsoby, které způsobují změnu některých fyzikálních vlastností dotyčného prvku, v těchto případech jde o izotopy. Například diamant a uhlík jsou látky vyrobené z chemického prvku uhlíku (C). ale to je organizováno různými způsoby a výsledkem jsou dva zcela odlišné materiály.
Carl sagan Řekl, že jsme hvězdný prach odrážející hvězdy. Tato krásná fráze není pouhou metaforou, ale vědeckým faktem. Chemické prvky se tvoří, pokud víme, uvnitř hvězd je výsledkem komplexu fúzní a atomové štěpné procesy, které generují stále těžší prvky, výsledek procesu zvaného nukleosyntéza.
Většinu známých prvků lze získat z přírody, spontánně nalezené nebo tvořící sloučeniny s jinými prvky, jako je uran (U), uhlík (C), křemík (Si), stříbro (Ag) nebo zlato (Au). Jiné byly naopak vyrobeny v laboratořích jako americium (Am), berkelium (Bk) nebo curium (Cm). Bez ohledu na způsob jeho získání nebo je -li přítomen v přírodě, v závislosti na jeho vlastnostech bude mít daný chemický prvek určitá použití nebo jiná.
V současné době je známo asi 118 chemických prvků, i když s ohledem na to, že lidé byli schopni vyrábět nové prvky, je otázkou času, kdy se periodická tabulka rozšíří.
- Mohlo by vás zajímat: „2 druhy elektřiny (vysvětleno)“
Hlavní typy chemických prvků
Hlavní typy chemických prvků jsou zastoupeny v periodické tabulce, systému klasifikaci vytvořil ruský chemik Dmitrij Mendělejev (1834-1907), který položil základy v 1869. Chemické prvky jsou uspořádány vizuálně na základě jejich vlastností a charakteristik.
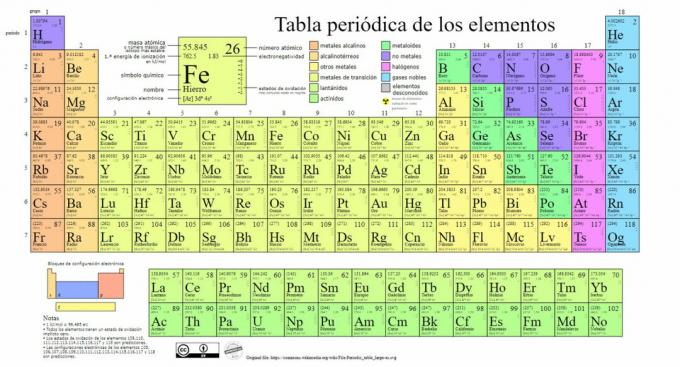
Postupem času a s tím, jak chemie učinila důležité vědecké objevy, bude tato tabulka postupně rozšiřována, dosahující dnešní podoby se 118 dosud známými prvky.
V současné době v této tabulce najdeme následující typy chemických prvků:
1. Kovy
Kovy jsou chemické prvky, které obecně obsahují jeden až tři elektrony na poslední oběžné dráze svého atomu, elektrony, které lze snadno přenášet což z nich činí vodiče tepla a elektřiny.
Kovy jsou obvykle tvárné a tvárné, s charakteristickým leskem, jehož intenzita závisí na pohybu elektronů, které tvoří jejich atomy. Kovy jsou při pokojové teplotě většinou pevné, kromě rtuti.
Mezi kovy najdeme zlato (Au), stříbro (Ag), měď (Cu) a hliník (Al), jejichž fyzikální vlastnosti z nich činí nádherné vodiče elektřiny, ačkoli jejich přítomnost v přírodě je velmi pestrá, odráží se v rozdílu mezi jejich váhami.
Předpokládá se, že 75% chemických prvků existujících v přírodě jsou kovy, zatímco zbývajících 25% bude tvořeno vzácnými plyny, metaloidy a jinými druhy.
V této kategorii existují klasifikace, které nacházejí aktinidy, lanthanoidy, přechodné kovy, alkalické kovy, kovy alkalických zemin a další kovy.
- Související článek: „10 potravin s vysokým obsahem zinku“
1.1. Lanthanoidy
Prvky lanthanidu se nacházejí v ložiskách složených z mnoha minerálů. Jsou to bílé kovy, které při kontaktu se vzduchem snadno oxidují. Mezi nimi najdeme Lanthanum (La), Promethium (Pm), Europium (Eu) a Ytterbium (Yb).

- Mohlo by vás zajímat: „5 typů chemických vazeb: takto se skládá hmota“
1.2. Aktinidy
Všechny izotopy aktinidů jsou radioaktivní. Najdeme mezi nimi aktinium (Ac), uran (U), plutonium (Pu) a einsteinium (Es).
1.3. Přechodné kovy
Přechodné kovy se nacházejí v centrální části periodické soustavy. Jeho hlavní charakteristikou je, že mají elektronickou konfiguraci orbitálu „d“ částečně vyplněnou elektrony.
V této skupině jsou látky všeho druhu a podle nejširší klasifikace by odpovídaly chemickým prvkům od 21 do 30, od 39 do 48, od 71 do 80 a od 103 do 112, což je celkem čtyřicet, a mezi nimi bychom našli vanad (V), ruthenium (Ru), stříbro (Ag), tantal (Ta) a lawrencio (Lr).

1.4. Alkalické kovy
Alkalické kovy jsou skupinou šesti prvků složených z lithia (Li), sodíku (Na), draslíku (K), rubidia (Rb), cesia (Cs) a francia (Fr). Jsou lesklé, měkké kovy, za normální teploty a tlaku vysoce reaktivní a snadno ztrácejí svůj vnější elektron, umístěný v jejich orbitálu „s“.
1.5. Alkalické zeminy
Kovy alkalických zemin jsou skupinou prvků, ve kterých najdeme berylium (Be), hořčík (Mg), vápník (Ca), stroncium (Sr), barium (Ba) a radium (Ra). Jeho název pochází z názvu jeho oxidů, „zemin“, které mají základní nebo zásadité vlastnosti.
Alkalické zeminy jsou tvrdší než zásadité, září a jsou dobrými elektrickými vodiči. Jsou méně reaktivní než alkalické a působí jako dobrá redukční činidla. Mají schopnost vytvářet iontové sloučeniny a všechny mají ve svém nejvzdálenějším obalu dva elektrony.

1.6. Jiné kovy
Kategorie „ostatní kovy“ je druh látek, které se zde nacházejí, protože vlastně nevíte, kam je dát.
Jsou to kovové prvky umístěné v periodické tabulce společně s metaloidy v bloku p. Bývají měkké s nízkými body tání. Mezi nimi jsou mimo jiné hliník (Al), indium (In), cín (Sn) a vizmut (Bi).

2. Žádné kovy
Nekovy mají na poslední oběžné dráze obvykle pět až sedm elektronů, což je vlastnost že místo toho, aby se jich vzdali, získávají elektrony, a tak se jim podaří mít osm elektronů, které je tak stabilizují jako atomy.
Tyto prvky jsou velmi špatnými vodiči tepla a elektřiny. Kromě toho nemají charakteristický lesk, nejsou příliš tvárné, málo tvárné a v pevném stavu jsou velmi křehké. Na rozdíl od kovů je nelze válcovat ani natahovat.
Jsou většinou nezbytné pro biologické systémy, protože jsou přítomny v organické sloučeniny, jako je síra (S), uhlík (C), kyslík (O), vodík (H) a jód (I).

- Související článek: „20 druhů drahých kamenů (popsaných a s obrázky)“
3. Metaloidy
Jak naznačuje jejich název, metaloidy jsou přechodná klasifikace mezi kovy a nekovy, které mají vlastnosti obou skupin. To je způsobeno skutečností, že na své poslední oběžné dráze mají čtyři atomy, což je mezilehlé množství kovů a nekovů.
Tyto chemické prvky vedou elektřinu pouze v jednom směru, což nedovoluje, aby to bylo provedeno v opačném směru, jako je tomu u kovů. Příkladem toho je křemík (Si), metaloid používaný díky této vlastnosti při výrobě polovodičových prvků pro elektronický průmysl.
Dalšími metaloidy jsou: bór (B), arsen (As), antimon (Sb) a polonium (Po).

4. Halogeny
Halogeny jsou skupinou šesti prvků, které mají tendenci tvořit molekuly složené ze dvou atomů (dvouatomových), které jsou díky své elektronegativitě velmi chemicky aktivní.
Tyto látky se obvykle objevují ve formě iontů, tj. Elektricky nabitých molekul, které jsou v tomto případě mononegativní, vysoce oxidující. To znamená, že halogeny jsou žíravé a korozivní látky.
Halogeny jsou: fluor (F), chlor (Cl), brom (Br), jód (I), astát (At) a tenese (Ts).

5. vzácné plyny
Vzácné plyny jsou skupinou sedmi, jejichž přirozený stav je plynný. Obvykle se objevují ve formě diatomických molekul velmi nízké reaktivity, to znamená, že nereagují s jinými prvky skládajícími jiné látky a ze stejného důvodu jsou známé jako inertní plyny. Důvodem je to, že na jeho poslední oběžné dráze existuje maximální počet možných elektronů pro tuto úroveň, celkem osm.
Tato vybraná skupina prvků se skládá z helia (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe), radon (Rn) a oganeson (Og), dříve známý jako ununoctium.
