Udviklingen af den PERIODISKE TABEL: fra dens oprettelse til i dag
Det periodiske system er et af mest ikoniske ikoner af videnskaben. Selvom 2019 var 150-året for oprettelsen, er det på ingen måde et færdigt dokument. I denne lektion fra en LÆRER vil vi se, hvad udvikling af det periodiske system fra dets oprettelse til i dag, og hvilke fremskridt inden for viden om atomer og deres egenskaber har gjort det muligt.
Indeks
- Hvad er det periodiske system?
- Første periodiske system: oprindelsen
- Historik om det periodiske system og evolution
Hvad er det periodiske system?
Det periodiske system Det periodiske system af elementer er det videnskabelige dokument, der koncentrerer mere information på mindre plads og udgør et af de mest magtfulde ikoner for videnskaben. Den indeholder en god del af viden, vi har om kemi. Der findes ikke noget lignende dokument i nogen anden videnskabelig disciplin.
Elementernes periodiske system er a klassificeringssystem for kemiske grundstoffer Det startede for mere end 200 år siden. Dette klassificeringssystem har vokset og ændret sig over tid, efterhånden som videnskaben skred frem, og nye blev opdaget.
kemiske grundstoffer. Imidlertid er de forskellige ændringer blevet indarbejdet, så den grundlæggende struktur er intakt.Det periodiske system er så navngivet på grund af udtrykker grafisk den måde de gentager med jævne mellemrum visse kemiske egenskaber. Det er en type todimensionel repræsentation eller i sine mere moderne repræsentationer tredimensionel.
I klassisk periodisk system (to-dimensionelle) de kemiske grundstoffer er arrangeret i grupper eller familier og er repræsenteret i den aktuelle periodiske tabel i lodrette kolonner. Det ordnede arrangement af disse grupper i kolonner giver anledning til en række rækker, der kaldes perioder, hvor elementerne er ordnet efter deres atomvægt. Det periodiske system består af syv perioder, der varierer i længde.

Første periodiske system: oprindelsen.
Før Mendeleev havde andre forskere udviklet klassificeringssystemer til kemiske grundstoffer. Men i modsætning til elementernes periodiske system var de det blotte lister over de kendte elementer; mens det periodiske system har den ejendommelighed, at det er et klassificeringssystem i to dimensioner (rækker og kolonner) eller tre dimensioner i de mest moderne versioner, hvor de kemiske grundstoffer er arrangeret i rækkefølge lag.
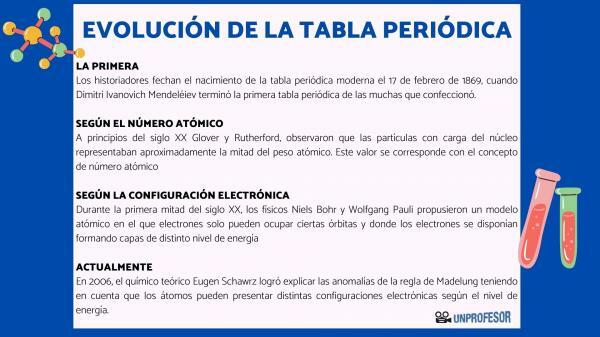
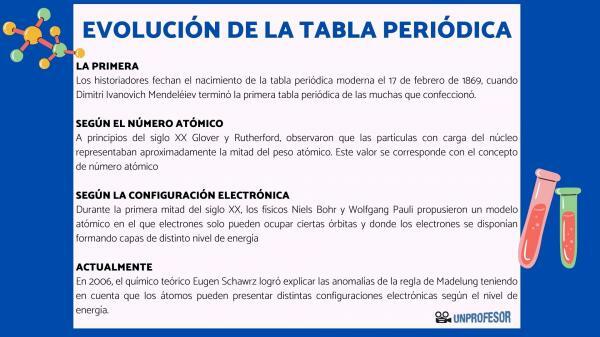
Af denne grund daterer historikere fødslen af det moderne periodiske system 17. februar 1869 hvornår Dimitri Ivanovich Mendeleev afslut første periodiske system af de mange, han lavede. Denne tabel bestod af 63 elementer arrangeret i familier og efterlod tomme rum for elementer endnu ikke opdaget, men hvorfra han havde udledt deres atomvægt (som i tilfældet med Gallium, Germanium og Scandium)
Nøgledataene til opdagelsen af det periodiske system var den tidligere kendskab til atomvægt af hvert element.
Hvad er atomvægt og atomnummer?
Dette nummer repræsenterede atomets vægt og det var den eneste målbare værdi af atomer. Men det var ikke under alle omstændigheder direkte målinger (der er ingen måleinstrumenter, der tillader vejning af isolerede atomer), men de var snarere et system, der etablerede en standard, hvor en vilkårlig værdi på 1 blev givet til hydrogenatomet, og værdien af atomvægten af de resterende elementer blev beregnet i forhold til dette Mønster.
De første beregninger af Atom nummer af elementerne blev udført af den engelske kemiker John daltonog skabte en stor videnskabelig debat i første halvdel af det 19. århundrede. Men i anden halvdel af det 19. århundrede var der allerede en bemærkelsesværdig konsensus om systemet til beregning af elementernes atomvægt. Atomvægten blev fra og med Mendeleev, et nøglekriterium for den korrekte rækkefølge af elementerne inden for det periodiske system.
Da Mendeleev beordrede de kendte elementer i henhold til deres stigende atomvægt, observerede forekomsten af tilbagevendende egenskaber, der gjorde det muligt at gruppere elementerne i grupper eller familier af elementer, der lignede hinanden. I nogle tilfælde reagerede ikke rækkefølgen af elementerne i henhold til deres atomvægt ikke på lighederne mellem elementer, der blev observeret, og Mendeleev blev ændret placeringen af 17 elementer i arrangementet af det periodiske system på trods af deres atomvægte for at kunne gruppere dem med de elementer, som de præsenterede analogier med.
Disse ændringer viste, at nogle af de accepterede atomvægte ikke var korrekte og blev genberegnet. På trods af korrektionerne i atomvægten var der stadig elementer, der skulle placeres i andre positioner end dem, der er angivet ved deres atomvægt.

Billede: BBC.com
Historik om det periodiske system og evolution.
På trods af Mendeleevs utvivlsomt bidrag er den periodiske tabel over elementer ikke resultatet af en enkelt forskers arbejde. Ud over Mendeleev, i anden halvdel af det nittende århundrede og gennem det tyvende århundrede mange Kemikere fortsatte med at undersøge den bedste måde at organisere information om kemiske grundstoffer på kendt. Endnu mere i betragtning af, at opdagelsen af nye kemiske grundstoffer eller enkle stoffertakket være spektrometri (som studerer interaktionen mellem atomer og elektromagnetisk stråling).
Det klassificering af elementer i det periodiske system var oprindeligt baseret på begyndende beregninger af atomvægte af elementerne og afslørede analogier, der gjorde det muligt at gruppere elementerne i analoge familier. Alligevel kunne årsagen til udseendet af disse periodiske egenskaber ikke forklares. Det var gennem det 20. århundrede med opdagelsen af elektronisk struktur, da årsagen til denne periodicitet i elementernes egenskaber blev forstået.
Atomtallet som en sorteringsrækkefølge
I begyndelsen af det 20. århundrede Glover og Rutherford, observerede, at de ladede partikler i kernen tegnede sig for ca. halvdelen af atomvægten. Denne værdi svarer til begrebet Atom nummer som er defineret som antallet af protoner i atomkernen, og som falder sammen med antallet af elektroner i et neutralt atom. Denne nye værdi retfærdiggjorde ændringerne i positionen for visse elementer, der var udført indtil da. For eksempel ændring af position mellem Tellurium og Jod.
I 1913, Henry Moseley bekræftede rækkefølgen af tabellen som en funktion af atomnummer ved røntgenspektrometri. Ordren efter atomnummeret er stadig i kraft i dag.
På samme tid, i løbet af det 20. århundrede, fortsatte nye kemiske grundstoffer at blive opdaget takket være kvantemekanik og udviklingen af teknikken til bombardement af atomer med partikler, fra anden halvdel af århundredet. Med denne nye teknik var det muligt at skabe kunstige elementer der ikke er til stede i naturen.
Selvom der var gjort fremskridt med den rigtige placering af elementerne inden for det periodiske system, stadig årsagen til den gentagne forekomst af visse egenskaber (egenskaberne periodisk). Udviklingen af kvantemekanik (gren af fysik, der studerer opførsel af lys og atomer i mikroskopisk skala) fra 1920 var afgørende for at forklare årsagen til disse egenskaber.
Elektronisk konfiguration som forklaring på periodiske egenskaber
I løbet af den første halvdel af det 20. århundrede, fysikere Niels Bohr Y Wolfgang Pauli de foreslog en atommodel, hvor elektroner kun kan optage bestemte baner, og hvor elektronerne er arrangeret og danner lag med forskellige energiniveauer. Den måde, hvorpå elektronerne fordeles i orbitalerne i de forskellige skaller eller energiniveauer, er kendt som elektronisk konfiguration.
Opdagelsen af arrangementet af elektroner i elektronkonfigurationer var grundlæggende for at forstå egenskabernes periodicitet. periodisk, da det blev observeret, at disse egenskaber var tæt beslægtet med den yderste elektroniske konfiguration af atomerne (lag af Valencia).
Den rækkefølge, i hvilken elektroner fylder atomorbitalerne, blev etableret i 1930 af fysiker Erwin Madelung, der etablerede en numerisk regel for påfyldningsrækkefølgen. Denne regel er kendt som Madelung hersker og det er en empirisk regel, der ikke kunne forklares ved hjælp af kvantemekanik.
Fyldningssekvensen er enkel for de første tre rækker i det periodiske system, men i fjerde række, hvor overgangselementerne er placeret, gennemgår rækkefølgen af påfyldning en række ændringer. Der er i alt 20 anomalier, der ikke følger denne regel.
Udviklingen af bordet fortsætter i dag
I 2006 blev den teoretiske kemiker Eugen Schawrz Han formåede at forklare anomalierne i Madelungs regel under hensyntagen til, at atomer kan have forskellige elektroniske konfigurationer afhængigt af energiniveauet. Ved beregning af gennemsnittene overholder elektronkonfigurationerne for de fleste elementer Madelungs regel.
Det periodiske system er fortsat et spørgsmål om debat i det 21. århundrede, skønt arrangementet eller den elektroniske konfiguration af elementerne, er det stadig gyldigt at forklare denne rækkefølge og de anomalier, der observeres i de elektroniske konfigurationer ved hjælp af en teori.
Hvis du vil læse flere artikler, der ligner Udviklingen af det periodiske system - resumé, anbefaler vi, at du indtaster vores kategori af Atomet.
Bibliografi
Forskellige forfattere. (2019)Specielt: det periodiske system. Forskning og videnskab. Barcelona: Scientific Press S.A.