Typer af kemiske FORMLER og EKSEMPLER

Kemiske forbindelser er til stede i alle objekter og levende væsener på vores planet. Når man forsøger at kende disse forbindelser, bruges formler, der kan være mere eller mindre komplekse, give mere eller mindre information, og kaldes kemiske formler. I dagens artikel en lærer Vi vil tale om de forskellige typer af kemiske formler og eksempler på dem. Hvis du vil vide mere om dem, informerer vi dig her!
Det kemiske formler er grafiske udtryk for elementerne der kommer til at danne de kemiske forbindelser, der findes. Disse formler udtrykker mængden og andelen af de forskellige atomer, der er en del af molekylet og Nogle typer formler repræsenterer også den type kemiske binding, der forbinder de forskellige elementer. Til hvert af de kendte molekyler eller forbindelser svarer der en kemisk nomenklatur etableret af den internationale union for ren og anvendt kemi (IUPAC) i henhold til den anvendte formeltype.
De forskellige typer kemiske formler, der findes give visse typer oplysninger selvom de generelt tjener til at forstå den kemiske natur af de stoffer, der danner den, og til at udtrykke hvad sker under en bestemt kemisk reaktion, da nogle grundstoffer eller forbindelser nogle gange kan omdannes til andre. Af denne grund følger kemiske formler a
repræsentativt system af grundstoffer og molekyler bestemt af et specialiseret teknisk sprog.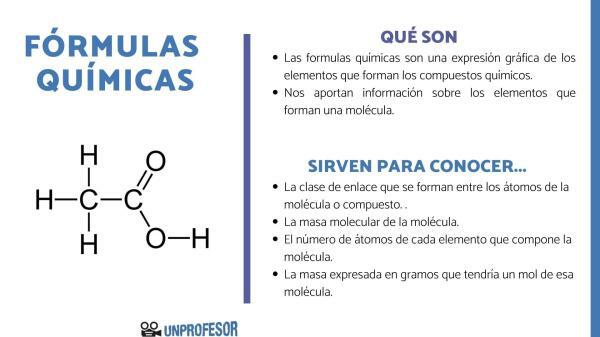
Som en generel regel, uanset typerne af kemiske formler, er disse formler sammensat af ca bogstavformede kemiske symboler der repræsenterer slags atom som danner molekylet iflg det periodiske system af grundstoffer og nogle tal i form af et underskrift ved siden af det kemiske symbol, der repræsenterer dets relative mængde i molekylet.
Inden for nogle kemiområder (især inden for organisk kemi) er der nogle kemiske grupper, der har strukturelt og funktionelt tilbagefald i molekyler, som giver os mulighed for at identificere bestemte fragmenter af et molekyle eller en forbindelse. Disse fragmenter af molekyler kaldes kemiske radikaler (når de har uparrede elektroner) eller kemiske grupper. funktionelle (når de er atomer eller enheder, der får forbindelsen til at reagere eller opføre sig på en bestemt måde) måde).
Nogle eksempler på kemiske radikaler de er methylradikalet (CH3), bromradikalet (Br-) eller chlorradikalet (Cl-). Eksempler på funktionelle grupper er carbonylgruppen (CO), hydroxylgruppen (OH) eller carboxylgruppen (COOH).

De forskellige typer af kemiske formler, der findes, bruger kemiske symboler for de grundstoffer, der udgør dem, og de logiske proportioner, der er etableret mellem dem, som er udtrykt med Matematiske symboler. De forskellige kemiske formler, der anvendes i nomenklaturen, er som følger.
Molekylær formel
Den molekylære formel er den mest grundlæggende formel af hvor mange der findes og udtrykker typen af atomer og antallet af hver til stede i forbindelsen. Formlen er meget enkel at skrive og fortolke, den præsenterer blot symbolerne for de kemiske grundstoffer og deres tal i form af sænkede i form af en lineær sekvens. For eksempel, vi har følgende formler:
- Basiske oxider: Na2O (natriumoxid), K2O (kaliumoxid), MgO (magnesiumoxid).
- Hydroxider: NaOH (natriumhydroxid) KOH (kaliumhydroxid), Ca (OH)2 (calciumhydroxid), Mg (OH)2 (magnesiumhydroxid)
- Syrer: HCl (saltsyre), H3PO4 (phosphorsyre), H2SO3 (svovlsyre), H2SO4 (svovlsyre)
- Salte: NaCl (natriumchlorid), Na2SO3 (natriumsulfit), Na2SO4 (natriumsulfat)
semi-udviklet formel
Den semi-udviklede formel ligner den molekylære formel og udtrykker de atomer, der udgør forbindelsen, de kemiske bindinger i form af linjer og hvilken type bindinger er dem, der forbinder forbindelsens atomer (simpel, dobbelt eller tredobbelt). I denne type formler er carbon-hydrogenbindinger dog ikke repræsenteret. Disse typer formler er meget udbredt i organisk kemi nomenklatur. Eksempler på disse typer formler er:
- Halvudviklede formler i organisk kemi: CH3-CH3 (ethan), CH3-CH2-OH (ethanol)
- Halvudviklede formler i uorganisk kemi: de er sjældne, nogle er PO(OH)3 (phosphorsyre), (OH)2P(O)OP(O)(OH)2 (pyrophosphorsyre)
udviklet formel
Dette er en anden af de typer kemiske formler. Den er lidt mere kompleks end den semi-udviklede. I denne type formel er bindingen og også atomets position i molekylet angivet, hvilket repræsenterer strukturen af forbindelsen i et kartesisk plan.
strukturel formel
Denne type kemiske formel er meget kompleks, men den giver en masse information om molekylerne, som repræsenterer, udover sin struktur og organisation, sin rumlige form i en bi eller tredimensionelle.
Lewis formel
De er også kendt som Lewis diagrammer eller Lewis-strukturer og ligner de udviklede formler, men også i dette tilfælde elektronerne, der deles i hver binding mellem atomer, er repræsenteret, som er repræsenteret af punkter, der er knyttet til linjernes linjer. Ikke-delte elektroner er også repræsenteret som prikker på atomerne. Disse formler er meget tekniske og bruges på meget specifikke områder.




