ALLE Eigenschaften des ATOM

Bild: SlideShare
Obwohl wir sie mit bloßem Auge nicht sehen können, Atome sind Teil aller Materie unseres Planeten. Alle Materie besteht aus Atomen, die sich zu chemischen Elementen, Molekülen, Verbindungen usw. Das Atom ist definiert als das kleinste Grundeinheit von Materie, die die Eigenschaften eines chemischen Elements hat. Jedes chemische Element wird durch die Art des Atoms definiert, aus dem es besteht. Die letzte Frage lautet also: Welche Eigenschaften hat das Atom? In dieser Lektion von einem LEHRER werden wir die Eigenschaften des Atoms die jedes Atom zu einem chemischen Element machen.
Index
- Was ist das Atom?
- Ordnungszahl, Massenzahl und Isotope
- Dichte, eine weitere Eigenschaft des Atoms
- Ionenradius und Vanderwalls-Radius
- Ionisationsenergie
Was ist das Atom?
Bevor wir die Eigenschaften des Atoms analysieren, ist es wichtig, dass wir besser wissen, worum es geht. Das Atom ist eine Einheit, die aus drei subatomaren Teilchen besteht: Protonen, Neutronen und Elektronen. Diese sind in Kern und Kortex organisiert.
- Das Ader Es ist ausgedacht Protonen Ja Neutronen, das sich im Zentrum des Atoms befindet und für den größten Teil des Gewichts des Atoms verantwortlich ist; Protonen sind positiv geladen, während Neutronen neutral sind, also ist der Kern positiv geladen.
- Das Kortex wird gebildet durch Elektronen, das sind kleine, negativ geladene Teilchen, die sich um den Kern drehen und dabei Umlaufbahnen bilden (wie die der Planeten), aber ohne jemals in den Kern des Atoms zu fallen. Die Rinde des Atoms ist für die Wechselwirkung mit der Rinde der anderen Atome verantwortlich, da sie sich außerhalb der Atome befindet.
Die verschiedenen Atome bestehen aus Protonen, Neutronen und Elektronen, die in allen chemischen Elementen gleich sind. Was macht also die verschiedenen chemischen Elemente aus? Die Anzahl der Protonen, Neutronen und Elektronen aus denen die Atome jedes Elements zusammengesetzt sind, ist unterschiedlich und dies wiederum führt dazu, dass jedes Element Eigenschaften oder andere.

Bild: SlideShare
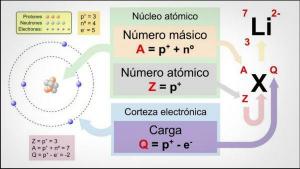
Die Ordnungszahl, die Massenzahl und die Isotope.
Die ersten drei Eigenschaften haben direkt mit der Anzahl der Teilchen zu tun, aus denen das Atom jedes Elements besteht.
Das Ordnungszahl (Z) gibt die Anzahl der Protonen an, die den Kern eines Atoms bilden. So haben zum Beispiel alle Eisenatome 26 Protonen in ihrem Kern. Darüber hinaus befinden sich die chemischen Elemente in einem neutralen Zustand, d. h. die positive (Protonen) und negative (Elektronen) Ladung ist gleich, also haben sie alle auch 26 Elektronen.
Das Massenzahl oder Atomgewicht (A) gibt die Gesamtzahl der Protonen und Neutronen an, die den Kern eines Atoms bilden. Wie bereits erwähnt, ist das Gewicht der Elektronen im Vergleich zu dem der Elektronen praktisch vernachlässigbar. Protonen und Neutronen, so dass die Massenzahl indirekt das Gewicht des betreffenden Atoms angibt. Um mit dem Beispiel von Eisen fortzufahren, wenn Sie das Periodensystem der Elemente konsultieren, werden Sie feststellen, dass das Gewicht Atom dieses Elements ist 55,85, was bedeutet, dass alle Atome dieses Elements das haben Gewicht.
Endlich, das Isotope eines chemischen Elements sind Varianten desselben Atoms (d. h. sie haben dieselbe Ordnungszahl), aber eine andere Massenzahl, dh eine andere Anzahl von Neutronen. Die meisten chemischen Elemente haben mehr als ein natürliches Isotop, wobei das Element mit der höchsten Menge an stabilen Isotopen Zinn (Sn) ist, das 10 verschiedene natürliche Isotope hat.

Bild: ConceptDefinition.de
Dichte, eine weitere Eigenschaft des Atoms.
Das Dichte eines Atoms ist die Anzahl der Masseneinheiten (um) des Elements, die in einem bestimmten Raumvolumen vorhanden sind. Die Dichte jeder Substanz wird durch den griechischen Buchstaben symbolisiert "Ro" (geschrieben r) und seine Einheiten nach dem Internationalen Einheitensystem (SI) sind Kilogramm pro Kubikmeter (kg / m3). Bei chemischen Elementen ist das Gramm pro Kubikzentimeter so klein (g / cm²3).
Damit Berechnen Sie die Dichte eines Atoms (Atomdichte) müssten wir die Masse des Atoms und sein Volumen berücksichtigen. Während sich der größte Teil der Masse des Atoms im Kern desselben befindet, muss das Volumen wie groß das Atom ist, und daher spielt die Anzahl der elektronischen Orbitale eine Rolle wichtig. Unter Berücksichtigung dieser Eigenschaften und ihrer Tendenz im Periodensystem können wir beobachten, dass die Die Dichte nimmt zu, wenn wir in einer Gruppe zunehmen und nimmt auch zu, wenn wir uns dem zentralen Teil nähern des Periodensystem.

Bild: YouTube
Ionenradius und Vanderwalls-Radius.
Das Ionenradius ist der Radius, den ein Ion eines Elements im ionischen Kristallzustand hat. In diesem Zustand sind die Ionen so nah beieinander, dass die äußersten Elektronenorbitale sich berühren.
Auf der anderen Seite ist die Vanderwall-Radius ist der Abstand, in dem zwei Atome aufgrund der Abstoßung negativer Ladungen zwischen den Elektronen jedes Atoms voneinander getrennt sind. Der Vanderwalls-Radius wäre der Radius einer imaginären festen Kugel, die verwendet wird, um das Atom zu modellieren, so dass er in der täglichen Praxis nicht viel verwendet wird.
Anders als bei Dichte oder Masse sind diese beiden Eigenschaften eng miteinander verbunden mit dem Volumen des Atoms, d.h. sie haben mehr mit der Elektronenzahl des Atoms zu tun als mit der Ader.

Bild: SlidePlayer
Ionisationsenergie.
Schließlich ist eine weitere Eigenschaft des Atoms die Ionisationsenergie, eine Eigenschaft, die uns die Energie angibt, die wir benötigen, um ein Elektron in seinem Grundzustand (außer einem Anion oder Kation) zu trennen. eines Atoms eines Elements im gasförmigen Zustand, könnte aber auch als die Kraft definiert werden, mit der sich ein Elektron an andere bindet Moleküle. Diese Eigenschaft ist sehr interessant, da wir uns so eine ungefähre Vorstellung von der Reaktionsfähigkeit eines Atoms eines bestimmten chemischen Elements. Die Ionisierungsenergie ist höher, wenn wir Elektronen entfernen, also gibt es für ein Element eine Energie von erste Ionisation, eine zweite Ionisationsenergie, und so weiter und sie werden immer größer.
Wie im vorherigen Fall hängt auch diese Eigenschaft eng mit der Anzahl der Orbitale des Element in Frage, denn je weniger Orbitale es hat, desto mehr kostet es, die Elektronen aus einem Atom zu entfernen entschlossen.

Bild: SlidePlayer
Wenn Sie mehr ähnliche Artikel lesen möchten Atomeigenschaften, wir empfehlen Ihnen, unsere Kategorie von Das Atom.