Die 10 Arten von chemischen Elementen (erklärt und klassifiziert)
Wie viele chemische Elemente müssen im Universum existieren? Diese Frage hat noch einen langen Weg vor sich, da Wissenschaftler von Zeit zu Zeit ihre eigenen künstlichen chemischen Elemente herstellen.
Was wir jedoch beantworten können ist wie viele Arten von chemischen Elementen müssen existieren, etwas, das wir als nächstes herausfinden werden.
- Verwandter Artikel: "Die 11 Arten chemischer Reaktionen"
Die Arten der chemischen Elemente
In der Natur finden wir alle möglichen Stoffe. Diese Stoffe kommen normalerweise nicht in reinem Zustand vor, sondern sind das Ergebnis der Kombination verschiedener Elemente oder Materialien, die durch unterschiedliche Reaktionen, Prozesse und Zeiträume alle Arten von Gegenstand. Es gibt nichts im Universum, das nicht das Ergebnis der Kombination von Atomen ist, die zu verschiedenen Arten chemischer Elemente gehören, die wir im Detail sehen werden.
Bevor wir uns jedoch die Arten chemischer Elemente ansehen, lassen Sie uns einen kleinen Überblick über die High-School-Wissenschaft geben und uns daran erinnern, was chemische Elemente sind.
Wir nennen "chemisches Element" Materie, die aus der gleichen Art von Atomen besteht, d. h. einer Substanz, die atomar rein ist. Chemische Elemente können nicht in einfachere zerlegt werden und werden in das Periodensystem eingeordnet der Elemente als reine Materialien des Universums.
Aber Vorsicht! Wir dürfen Elemente nicht mit einfachen Stoffen verwechseln, da sich in bestimmten Fällen zwei oder mehr Atome desselben Elements zusammensetzen können Moleküle, die auf unterschiedliche Weise gruppiert sind und dazu führen, dass einige der physikalischen Eigenschaften des betreffenden Elements variieren Isotope. Diamant und Kohlenstoff sind beispielsweise Stoffe, die aus dem chemischen Element Kohlenstoff (C) bestehen. aber das ist unterschiedlich organisiert und führt zu zwei völlig unterschiedlichen Materialien.
Carl Sagan Es sagte, dass wir Sternenstaub sind, der sich auf Sterne spiegelt. Dieser schöne Satz ist keine bloße Metapher, sondern eine wissenschaftliche Tatsache. Chemische Elemente entstehen, soweit wir wissen, im Inneren von Sternen als Ergebnis komplexer Fusions- und Atomspaltungsprozesse, die immer schwerere Elemente erzeugen, das Ergebnis eines Prozesses namens Nukleosynthese.
Die meisten der bekannten Elemente können aus der Natur gewonnen werden, spontan gefunden werden oder mit anderen Elementen wie Uran (U), Kohlenstoff (C), Silizium (Si), Silber (Ag) oder Gold (Au) Verbindungen eingehen. Andere hingegen wurden in Laboratorien hergestellt, wie Americium (Am), Berkelium (Bk) oder Curium (Cm). Unabhängig von der Art seiner Gewinnung oder seinem Vorkommen in der Natur wird das fragliche chemische Element je nach seinen Eigenschaften einige Verwendungen haben.
Gegenwärtig sind etwa 118 chemische Elemente bekannt, aber wenn man bedenkt, dass der Mensch in der Lage ist, neue Elemente herzustellen, ist es eine Frage der Zeit, bis sich das Periodensystem erweitert.
- Sie könnten interessiert sein an: "Die 2 Stromarten (erklärt)"
Die wichtigsten Arten von chemischen Elementen
Die wichtigsten Arten chemischer Elemente sind im Periodensystem vertreten, einem System von Klassifikation des russischen Chemikers Dmitri Mendeleev (1834-1907) 1869. Chemische Elemente werden anhand ihrer Eigenschaften und Eigenschaften visuell geordnet.
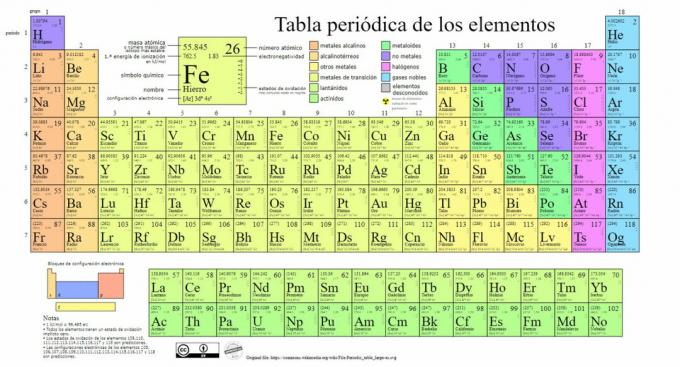
Im Laufe der Zeit und als die Chemie wichtige wissenschaftliche Entdeckungen machte, wurde diese Tabelle fortlaufend erweitert, erreicht mit den bisher bekannten 118 Elementen seine heutige Form.
Derzeit finden wir in dieser Tabelle die folgenden Arten von chemischen Elementen:
1. Metalle
Metalle sind chemische Elemente, die auf der letzten Umlaufbahn ihres Atoms im Allgemeinen ein bis drei Elektronen enthalten, die leicht übertragen werden können machen sie zu Leitern von Wärme und Elektrizität.
Metalle sind normalerweise formbar und duktil, mit einem charakteristischen Glanz, dessen Intensität von der Bewegung der Elektronen abhängt, aus denen ihre Atome bestehen. Die meiste Zeit sind Metalle bei Raumtemperatur fest, mit Ausnahme von Quecksilber.
Unter den Metallen finden wir Gold (Au), Silber (Ag), Kupfer (Cu) und Aluminium (Al), deren physikalische Eigenschaften sie zu hervorragenden Stromleitern machen, obwohl ihr Vorkommen in der Natur sehr unterschiedlich ist, was sich in den unterschiedlichen Gewichten widerspiegelt.
Es wird angenommen, dass 75 % der in der Natur vorkommenden chemischen Elemente Metalle sind, während die restlichen 25 % aus Edelgasen, Metalloiden und anderen Typen bestehen.
Es gibt Klassifikationen innerhalb dieser Kategorie, die Actiniden, Lanthanoide, Übergangsmetalle, Alkalimetalle, Erdalkalimetalle und andere Metalle finden.
- Verwandter Artikel: "10 Lebensmittel mit viel Zink"
1.1. Lanthanoide
Lanthanoid-Elemente kommen in Ablagerungen vor, die aus vielen Mineralien bestehen. Sie sind Weißmetalle, die bei Kontakt mit Luft leicht oxidieren. Darunter finden wir Lanthan (La), Promethium (Pm), Europium (Eu) und Ytterbium (Yb).

- Sie könnten interessiert sein an: "Die 5 Arten chemischer Bindungen: So ist die Materie zusammengesetzt"
1.2. Aktiniden
Alle Isotope von Aktiniden sind radioaktiv. Darunter finden wir Actinium (Ac), Uran (U), Plutonium (Pu) und Einsteinium (Es).
1.3. Übergangsmetalle
Übergangsmetalle befinden sich im zentralen Teil des Periodensystems. Sein Hauptmerkmal ist, dass eine elektronische Konfiguration des "d"-Orbitals haben, die teilweise mit Elektronen gefüllt ist.
In dieser Gruppe gibt es Stoffe aller Art und nach ihrer weitesten Einteilung entspräche sie den chemischen Elementen 21 bis 30, 39 bis 48, von 71 bis 80 und von 103 bis 112, insgesamt sind es vierzig und darunter finden wir Vanadium (V), Ruthenium (Ru), Silber (Ag), Tantal (Ta) und Lawrencio (Herr).

1.4. Alkali Metalle
Die Alkalimetalle sind eine Gruppe von sechs Elementen, die aus Lithium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Cäsium (Cs) und Francium (Fr) bestehen.. Sie sind glänzende, weiche Metalle, die bei normaler Temperatur und normalem Druck hochreaktiv sind und leicht ihr äußeres Elektron verlieren, das sich in ihrem "s"-Orbital befindet.
1.5. Erdalkalien
Die Erdalkalimetalle sind eine Gruppe von Elementen, in der wir Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr), Barium (Ba) und Radium (Ra) finden. Sein Name kommt von der Bezeichnung seiner Oxide, "Erden", die basische oder alkalische Eigenschaften haben.
Die Erdalkalien sie sind härter als alkalisch, glänzen und sind gute elektrische Leiter. Sie sind weniger reaktiv als alkalische und wirken als gute Reduktionsmittel. Sie haben die Fähigkeit, ionische Verbindungen zu bilden, und sie alle haben zwei Elektronen in ihrer äußersten Schale.

1.6. Andere Metalle
Die Kategorie "andere Metalle" ist eine Art von Substanzen, die hier zu finden sind, weil man nicht wirklich weiß, wo man sie hinstellen soll.
Sie sind metallische Elemente, die im Periodensystem zusammen mit den Metalloiden innerhalb des p-Blocks stehen. Sie neigen dazu, weich mit niedrigen Schmelzpunkten zu sein. Darunter sind unter anderem Aluminium (Al), Indium (In), Zinn (Sn) und Wismut (Bi).

2. Keine Metalle
Nichtmetalle besitzen auf ihrer letzten Umlaufbahn im Allgemeinen zwischen fünf und sieben Elektronen, eine Eigenschaft, die dass sie Elektronen aufnehmen, anstatt sie abzugeben, und so schaffen sie es, acht Elektronen zu haben, die sie so stabilisieren, da Atome.
Diese Elemente sie sind sehr schlechte Wärme- und Stromleiter. Außerdem haben sie keinen charakteristischen Glanz, sind wenig formbar, wenig duktil und im festen Zustand sehr zerbrechlich. Sie können im Gegensatz zu Metallen nicht gewalzt oder gestreckt werden.
Sie sind für biologische Systeme meist essenziell, da sie in organische Verbindungen wie Schwefel (S), Kohlenstoff (C), Sauerstoff (O), Wasserstoff (H) und Jod (I).

- Verwandter Artikel: "Die 20 Arten von Edelsteinen (beschrieben und mit Bildern)"
3. Metalloide
Wie der Name schon sagt, sind Metalloide eine Zwischenklassifikation zwischen Metallen und Nichtmetallen, die Eigenschaften beider Gruppen aufweisen. Dies liegt daran, dass sie auf ihrer letzten Umlaufbahn vier Atome haben, eine Zwischenmenge, zu der Metalle und Nichtmetalle haben.
Diese chemischen Elemente leiten den Strom nur in eine Richtung und lassen ihn nicht in die entgegengesetzte Richtung wie bei Metallen. Ein Beispiel dafür ist Silizium (Si), ein Metalloid, das dank dieser Eigenschaft bei der Herstellung von Halbleiterelementen für die Elektronikindustrie verwendet wird.
Andere Metalloide sind: Bor (B), Arsen (As), Antimon (Sb) und Polonium (Po).

4. Halogene
Halogene sind eine Gruppe von sechs Elementen, die sie neigen dazu, Moleküle aus zwei Atomen (zweiatomig) zu bilden, die aufgrund ihrer Elektronegativität chemisch sehr aktiv sind.
Diese Substanzen treten normalerweise in Form von Ionen auf, dh elektrisch geladenen Molekülen, die in diesem Fall mononegativ sind und stark oxidieren. Dies bedeutet, dass Halogene ätzende und korrosive Stoffe sind.
Die Halogene sind: Fluor (F), Chlor (Cl), Brom (Br), Jod (I), Astat (At) und Tenese (Ts).

5. Edelgase
Die Edelgase sind eine Gruppe von sieben, deren natürlicher Zustand gasförmig ist. Sie treten normalerweise in Form von zweiatomigen Molekülen mit sehr geringer Reaktivität auf, dh sie reagieren nicht mit anderen Elementen, die andere Substanzen bilden und aus dem gleichen Grund werden sie als Inertgase bezeichnet. Dies liegt daran, dass auf seiner letzten Umlaufbahn die maximal mögliche Anzahl von Elektronen für diese Ebene vorhanden ist, insgesamt acht.
Diese ausgewählte Gruppe von Elementen besteht aus Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe), Radon (Rn) und Oganson (Og), früher bekannt als Ununoctium.


