Σε τι χρησιμεύει ο ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ;
Ο περιοδικός πίνακας είναι ένα σύστημα ταξινόμησης για ατομικά στοιχεία που εφευρέθηκε το 1869 από τον Ρώσο χημικό Ο Ντμίτρι Μεντελέγιεφ και αργότερα αναδιοργανώθηκε και ενημερώθηκε από άλλους χημικούς μέχρι να φτάσει στην εμφάνισή του ρεύμα. Παρά το ότι είναι ένα εργαλείο που έχει αποδειχθεί χρήσιμο σε όλη την ιστορία (γι 'αυτό συνέχισε να χρησιμοποιείται και να ενημερώνεται), είναι ένα τόσο κουραστικό να μάθουμε και να κατανοήσουμε, γι 'αυτό όλοι έχουμε αναρωτηθεί για την ερώτηση "Για ποιον πίνακα; περιοδικό; ".
Αν θέλετε να μάθετε για ποιον είναι ο περιοδικός πίνακας για και γιατί είναι σημαντικό να κατανοήσουμε τις ιδιότητές του, συνεχίστε να διαβάζετε αυτό το μάθημα από έναν ΔΑΣΚΑΛΟ.
Δείκτης
- Ταξινόμηση του περιοδικού πίνακα
- Εύρεση του ονόματος ή του συμβόλου ενός στοιχείου με τον περιοδικό πίνακα
- Γνωρίστε την ατομική μάζα ενός στοιχείου
- Γνωρίστε τον ατομικό αριθμό ενός στοιχείου
- Προβλέψτε την ατομική ακτίνα ενός στοιχείου
- Συγκρίνετε την ενέργεια ιονισμού δύο στοιχείων
- Εύρεση της ηλεκτροπαραγωγικής ικανότητας ενός χημικού στοιχείου
- Συγκρίνετε τη συγγένεια ηλεκτρονίων δύο στοιχείων
Ταξινόμηση του περιοδικού πίνακα.
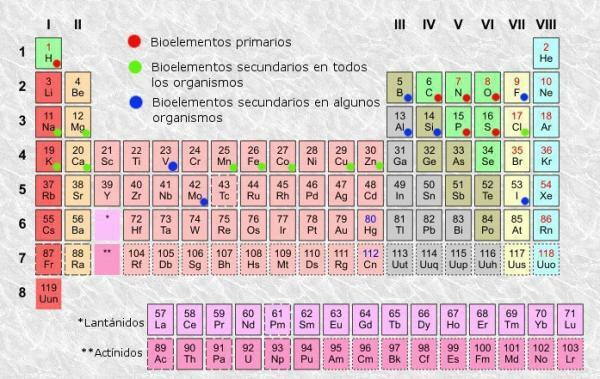
Όπως σε οποιονδήποτε πίνακα, στο ο περιοδικός πίνακας από τα στοιχεία μπορούμε να διακρίνουμε στήλες (κάθετες) και σειρές (οριζόντιες). Στον περιοδικό πίνακα υπάρχουν 18 στήλες ή ομάδες και 7 σειρές ή τελείες.
Επιπλέον, θα έχετε τη δυνατότητα να επιβεβαιώσετε ότι συνήθως σε κάθε ένα από τα πλαίσια του πίνακα, εμφανίζονται τουλάχιστον οι ακόλουθες πληροφορίες:
- Σύμβολο χημικού στοιχείου: συντομογραφίες ή σημεία που χρησιμοποιούνται για τον προσδιορισμό των στοιχείων. Συνήθως αποτελούνται από ένα ή δύο γράμματα, από τα οποία το πρώτο είναι πάντα κεφαλαίο.
- Όνομα χημικού στοιχείου: όνομα του χημικού στοιχείου που αντιστοιχεί στην ανώτερη συντομογραφία. Είναι συνήθως κάτω από το σύμβολο.
- Ατομικός αριθμός: συνολικός αριθμός πρωτονίων που έχει κάθε άτομο αυτού του στοιχείου. Συνήθως εμφανίζεται στην επάνω αριστερή γωνία του πλαισίου αντικειμένων (ή στην επάνω δεξιά πλευρά των πιο πλήρων πινάκων).
- Ατομική μάζα: μάζα ενός ατόμου μπορεί κανονικά να θεωρηθεί ως η συνολική μάζα των πρωτονίων και των νετρονίων σε ένα μόνο άτομο. Είναι διαθέσιμο κάτω από το όνομα του στοιχείου στους απλούστερους πίνακες, αν και σε άλλους μπορεί να εμφανίζεται στο επάνω δεξιό μέρος του πλαισίου στοιχείων.
Υπάρχουν περιοδικοί πίνακες που περιλαμβάνουν άλλες πιο περίπλοκες και συγκεκριμένες πληροφορίες όπως καταστάσεις οξείδωσης (χρήσιμο κατά τη διαμόρφωση χημικών ενώσεων, για παράδειγμα), ενέργεια ιονισμού, ηλεκτροναγονητικότητα κ.λπ. δώστε αρκετές πληροφορίες και συνήθως είναι αρκετές για τον μέσο χρήστη, ο οποίος από αυτόν μπορεί να βρει πληροφορίες όπως αυτή που σας λέμε παρακάτω.

Μάθετε το όνομα ή το σύμβολο ενός στοιχείου με τον περιοδικό πίνακα.
Μερικές φορές ξέρουμε το σύμβολο χημικού στοιχείου αλλά δεν ξέρουμε το όνομά του. Άλλες φορές, γνωρίζουμε το όνομα χημικού στοιχείου, αλλά όχι η συντομογραφία ή το σύμβολό του. Στην πραγματικότητα, είναι πολύ εύκολο που αυτό σας συνέβη ποτέ στην τάξη.
Σε αυτές τις περιπτώσεις, μπορούμε να χρησιμοποιήσουμε έναν περιοδικό πίνακα, χωρίς να χρειάζεται να είναι περίπλοκος και να συμβουλευτούμε τα δεδομένα που λείπουν γρήγορα και με ακρίβεια.
Γνωρίστε την ατομική μάζα ενός στοιχείου.
Μερικές φορές γνωρίζουμε το χημικό στοιχείο που αντιμετωπίζουμε, αλλά πρέπει να το γνωρίζουμε ατομική μάζα, δηλαδή, το βάρος ενός ατόμου αυτού του στοιχείου.
Αυτές οι πληροφορίες θα είναι χρήσιμες, για παράδειγμα, κατά την εκτέλεση των ακόλουθων εργασιών:
- Υπολογίστε τη συγκεκριμένη ποσότητα μιας ουσίας.
- Αναλύστε τα αποτελέσματα που αποκτήθηκαν στις δοκιμές ή τα πειράματα.
- Υπολογίστε το ποσοστό της μάζας.
- Κατανοήστε τις ακριβείς μοριακές μάζες σύνθετων μορίων.
Γνωρίστε τον ατομικό αριθμό ενός στοιχείου.
Ο ατομικός αριθμός είναι συνολικός αριθμός πρωτονίων που έχει ένα άτομο ενός στοιχείου. Σε ένα ηλεκτρικά ουδέτερο άτομο, εκτός από ένα κατιόν (θετικά φορτισμένο, με ένα ηλεκτρόνιο λιγότερο από την κανονική του κατάσταση) ή ένα ανιόν (αρνητικά φορτισμένο, με ένα περισσότερο ηλεκτρόνιο από την κανονική του κατάσταση), ο αριθμός των πρωτονίων είναι ίσος με αυτόν του ηλεκτρόνια.
Ο αριθμός των πρωτονίων είναι ο αποφασιστικός παράγοντας για τη διάκριση ενός στοιχείου από το άλλο, καθώς ο αριθμός των ηλεκτρονίων ή των νετρονίων δεν αλλάζει τον τύπο του στοιχείου.

Προβλέψτε την ατομική ακτίνα ενός στοιχείου.
Η ατομική ακτίνα είναι η μισή απόσταση μεταξύ του κέντρου δύο ατόμων του ίδιου στοιχείου που μόλις αγγίζουν το ένα το άλλο. Σε αυτήν την περίπτωση, ξέρετε το θέση ενός χημικού στοιχείου στον περιοδικό πίνακα Μπορεί να μας βοηθήσει να ανακαλύψουμε την ατομική του ακτίνα κατά προσέγγιση ή σε σύγκριση με ένα άλλο στοιχείο. Για αυτό, πρέπει να το ξέρουμε αυτό την ατομική ακτίνα:
- Αυξάνεται καθώς κινούμαστε από την κορυφή στο κάτω μέρος του περιοδικού πίνακα.
- Κατεβαίνει καθώς κινούμαστε από αριστερά προς τα δεξιά μέσω του περιοδικού πίνακα.
Με αυτόν τον τρόπο, το ασβέστιο είναι μικρότερο από το ρουβίδιο αλλά μεγαλύτερο από τον σίδηρο.
Μάθε περισσότερα για Τι είναι η ατομική ακτίνα με αυτό το άλλο μάθημα βίντεο από έναν εκπαιδευτή.
Συγκρίνετε την ενέργεια ιονισμού δύο στοιχείων.
ο ενέργεια ιονισμού είναι το ενέργεια που απαιτείται για την αφαίρεση ενός ηλεκτρονίου από το άτομο ενός στοιχείου. Σε αυτήν την περίπτωση, εάν γνωρίζουμε τη θέση δύο στοιχείων στον περιοδικό πίνακα, μπορούμε να γνωρίζουμε ποιο στοιχείο θα είναι ευκολότερο να "αφαιρέσουμε" ένα ηλεκτρόνιο. Θα πρέπει μόνο να λάβουμε υπόψη ότι:
- Η ενέργεια ιονισμού μειώνεται καθώς κινείται πάνω και κάτω στον περιοδικό πίνακα.
- Η ενέργεια ιονισμού αυξάνεται καθώς κινείστε από τα αριστερά προς τα δεξιά του περιοδικού πίνακα.
Μεταξύ βηρυλλίου και οξυγόνου, το οξυγόνο έχει περισσότερη ενέργεια ιονισμού. Εάν συγκρίνουμε το οξυγόνο και το θείο, το οποίο είναι στην ίδια ομάδα αλλά στην επόμενη περίοδο, το οξυγόνο έχει επίσης υψηλότερη ενέργεια ιονισμού καθώς είναι υψηλότερο στον περιοδικό πίνακα.
Βρείτε την ηλεκτροπαραγωγική ικανότητα ενός χημικού στοιχείου.
Ηλεκτροπαραγωγικότητα είναι το ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια. Στην πράξη αυτό μεταφράζεται στην ικανότητα σχηματισμού χημικού δεσμού. Για να γνωρίζουμε εάν ένα χημικό στοιχείο θα έχει μεγάλη ικανότητα να σχηματίσει χημικό δεσμό ή όχι, πρέπει μόνο να λάβουμε υπόψη το μοτίβο που ακολουθεί στον περιοδικό πίνακα, δηλαδή:
- Κατεβαίνει καθώς κινείται πάνω-κάτω.
- Αυξάνεται καθώς μετακινείστε από αριστερά προς τα δεξιά.
Όπως και στην προηγούμενη περίπτωση, το οξυγόνο είναι πιο ηλεκτροαρνητικό από το βηρύλλιο και το θείο, καθώς είναι πιο δεξιά από το πρώτο και υψηλότερο από το θείο.

Συγκρίνετε τη συγγένεια ηλεκτρονίων δύο στοιχείων.
ο Ηλεκτρονική συγγένεια είναι αυτός αλλαγή στην ενέργεια που υφίσταται ένα ουδέτερο άτομο όταν προσελκύει ένα ηλεκτρόνιο να γίνει αρνητικό ιόν. Σε αυτήν την περίπτωση, η ηλεκτρονική συγγένεια δεν διαφέρει όπως ακριβώς στις προηγούμενες περιπτώσεις, αν και μπορούμε να πούμε ότι, γενικά, η ηλεκτρονική συγγένεια:
- Αυξάνεται, την ίδια περίοδο, από αριστερά προς τα δεξιά.
- Ανεβείτε, στην ίδια ομάδα, από κάτω προς τα πάνω.
Αν θέλετε να διαβάσετε περισσότερα άρθρα παρόμοια με Σε τι χρησιμεύει ο περιοδικός πίνακας;, σας συνιστούμε να εισαγάγετε την κατηγορία μας Το άτομο.
βιβλιογραφικές αναφορές
Έχετε κάποια στοιχεία ή σχόλια σχετικά με τις χρήσεις του περιοδικού πίνακα; Μη διστάσετε να το αφήσετε στην ενότητα σχολίων μας! Σας άρεσε αυτό το άρθρο; Μπορείτε επίσης να αφήσετε την αξιολόγησή σας παρακάτω!