Οι 10 τύποι χημικών δεσμών (εξηγούνται με παραδείγματα)
Οι χημικοί δεσμοί είναι οι δυνάμεις που συγκρατούν τα άτομα μαζί για να σχηματίσουν τα μόρια. Υπάρχουν τρεις τύποι δεσμών μεταξύ ατόμων:
- Μεταλλικός δεσμός.
- Ιοντικός δεσμός.
- Ομοιοπολικός δεσμός: μη πολικός, πολικός, απλός, διπλός, τριπλός, αρχικός.
Χάρη σε αυτούς τους δεσμούς, σχηματίζονται όλες οι ενώσεις που υπάρχουν στη φύση. Υπάρχουν επίσης δυνάμεις που συγκρατούν τα μόρια, γνωστά ως διαμοριακοί δεσμοί, όπως:
- Δεσμοί υδρογόνου ή γέφυρες.
- Δίπολο διπολικό.
Στη συνέχεια, εξηγούμε κάθε έναν από αυτούς τους συνδέσμους.
| Τύποι χημικών δεσμών | Χαρακτηριστικό γνώρισμα | Παραδείγματα | |
|---|---|---|---|
| Μέταλλο | Τα μεταλλικά ιόντα επιπλέουν σε μια θάλασσα κινούμενων ηλεκτρονίων. | Μεταλλικά στοιχεία: νάτριο, βάριο, ασήμι, σίδηρος, χαλκός. | |
| ιωνικός | Μεταφορά ηλεκτρονίων από ένα άτομο σε άλλο. | Χλωριούχο νάτριο Na+Κλ- | |
| Ομοιοπολικός | Μη πολικό | Μοιραστείτε τα ηλεκτρόνια εξίσου μεταξύ δύο ατόμων. | Μοριακό υδρογόνο Η-Η ή Η2 |
| Πολικός | Μοιραστείτε τα ηλεκτρόνια άνισα μεταξύ δύο ατόμων. | Μόριο νερού Η2Ή | |
| Απλός | Μοιραστείτε ένα ζευγάρι ηλεκτρονίων. | Μόριο χλωρίου Cl2 Cl-Cl | |
| Διπλό | Μοιραστείτε δύο ζεύγη ηλεκτρονίων. | Μόριο οξυγόνου Ο2 Ο = Ο | |
| Τριπλούς | Μοιραστείτε τρία ζεύγη ηλεκτρονίων. | Μόριο αζώτου N≣N ή N2 | |
| Δοτική πτώση | Μόνο ένα από τα άτομα μοιράζεται τα ηλεκτρόνια. | Σύνδεση μεταξύ αζώτου και βορίου στην ένωση τριφθοριούχου αμμωνίας-βορίου. | |
| Διαμοριακές δυνάμεις | Γέφυρα υδρογόνου | Τα υδρογόνα σε ένα μόριο προσελκύονται στα ηλεκτροαρνητικά άτομα ενός άλλου μορίου. | Το υδρογόνο συνδέεται μεταξύ του υδρογόνου σε ένα μόριο νερού με το οξυγόνο σε ένα άλλο μόριο νερού. |
| Διπόλο-δίπολο | Μόρια με δύο ηλεκτρικούς πόλους προσελκύουν τους αντίθετους πόλους άλλων μορίων. | Αλληλεπιδράσεις μεταξύ των μορίων μεθανίου Η2Γ = Ο |
Μεταλλικός δεσμός
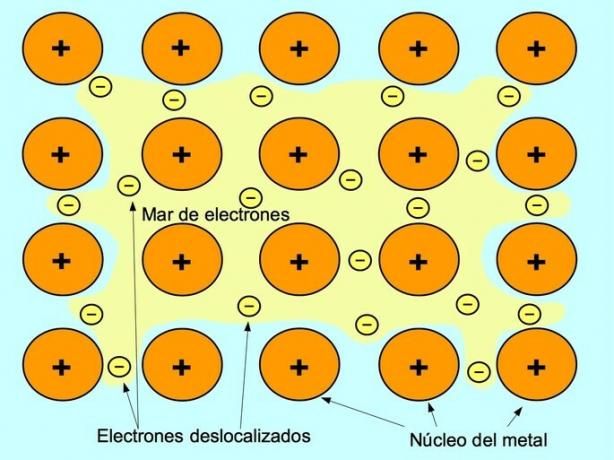
Ο μεταλλικός δεσμός είναι η δύναμη έλξης μεταξύ των θετικών ιόντων των μεταλλικών στοιχείων και των αρνητικών ηλεκτρονίων που κινούνται ελεύθερα μεταξύ των ιόντων. Τα μεταλλικά άτομα είναι σφιχτά συσκευασμένα, επιτρέποντας στα ηλεκτρόνια να κινούνται εντός του πλέγματος ατόμων.
Στα μέταλλα, τα ηλεκτρόνια σθένους απελευθερώνονται από το αρχικό τους άτομο και σχηματίζουν μια "θάλασσα" ηλεκτρονίων που αιωρείται γύρω από ολόκληρη τη μεταλλική κατασκευή. Αυτό αναγκάζει τα μεταλλικά άτομα να μετατραπούν σε θετικά φορτισμένα μεταλλικά ιόντα που συσκευάζονται μαζί.
Ο μεταλλικός δεσμός δημιουργείται μεταξύ μεταλλικών στοιχείων όπως νατρίου Na, βαρίου Ba, ασβεστίου Ca, μαγνησίου Mg, χρυσού Au, αργύρου Ag και αλουμινίου Al.
Ιοντικός δεσμός
Ο ιονικός δεσμός είναι η δύναμη που ενώνει ένα μεταλλικό στοιχείο, όπως νάτριο ή μαγνήσιο, με ένα μη μεταλλικό στοιχείο, όπως χλώριο ή θείο. Το μέταλλο χάνει ηλεκτρόνια και μετατρέπεται σε θετικό μεταλλικό ιόν που ονομάζεται κατιόν. Αυτά τα ηλεκτρόνια περνούν στο μη μεταλλικό στοιχείο και μετατρέπεται σε αρνητικά φορτισμένο ιόν ανιόν.
Τα κατιόντα και τα ανιόντα συνδυάζουν και σχηματίζουν ένα τρισδιάστατο δίκτυο που διατηρείται από τις δυνάμεις της ηλεκτροστατικής έλξης μεταξύ των ιόντων με διαφορετικά φορτία. Αυτές οι δυνάμεις σχηματίζουν ιοντικές ενώσεις.
Ο φλοιός της γης αποτελείται κυρίως από ιοντικές ενώσεις. Οι περισσότεροι βράχοι, μέταλλα και πολύτιμοι λίθοι είναι ιονικές ενώσεις. Για παράδειγμα:
- Χλωριούχο νάτριο NaCl: το μεταλλικό στοιχείο είναι νάτριο που μεταφέρει ένα ηλεκτρόνιο σε χλώριο, το οποίο είναι το μη μεταλλικό στοιχείο.
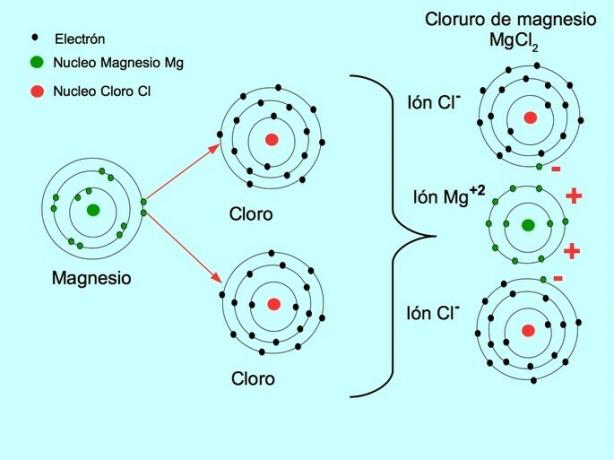
- Χλωριούχο μαγνήσιο MgCl2: Το μαγνήσιο Mg δίνει δύο ηλεκτρόνια σε δύο άτομα χλωρίου, όπως φαίνεται στο παρακάτω σχήμα:
Δείτε επίσης Διαφορά μεταξύ κατιόντων και ανιόντων.
Ομοιοπολικό δεσμό
Ο ομοιοπολικός δεσμός σχηματίζεται όταν δύο μη μεταλλικά άτομα μοιράζονται ηλεκτρόνια. Αυτός ο δεσμός μπορεί να είναι διαφόρων τύπων ανάλογα με τη συγγένεια για τα ηλεκτρόνια των ατόμων και την ποσότητα των κοινών ηλεκτρονίων.
Μη πολικός ομοιοπολικός δεσμός
Ο μη πολικός ομοιοπολικός δεσμός είναι ο δεσμός που σχηματίζεται μεταξύ δύο ατόμων όπου τα ηλεκτρόνια μοιράζονται εξίσου. Αυτός ο δεσμός εμφανίζεται συνήθως σε συμμετρικά μόρια, δηλαδή σε μόρια που αποτελούνται από δύο ίσα άτομα, όπως το μόριο υδρογόνου Η2 και το μόριο οξυγόνου Ο2.

Πολικός ομοιοπολικός δεσμός
Ο πολικός ομοιοπολικός δεσμός σχηματίζεται όταν δύο άτομα μοιράζονται ηλεκτρόνια αλλά ένα από αυτά έχει μεγαλύτερη έλξη για ηλεκτρόνια. Αυτό κάνει το μόριο να έχει ένα πιο αρνητικό "πόλο" με περισσότερα ηλεκτρόνια και ο αντίθετος πόλος είναι πιο θετικός.
Τα μόρια με αυτήν την κατανομή ή ανισορροπία των ηλεκτρονίων είναι γνωστά ως πολικά. Για παράδειγμα, στο υδροφθόριο HF, υπάρχει ένας ομοιοπολικός δεσμός μεταξύ υδρογόνου και φθορίου, αλλά το φθόριο έχει υψηλότερη ηλεκτροαρνητικότητα, έτσι προσελκύει τα ηλεκτρόνια πιο έντονα κοινόχρηστο.
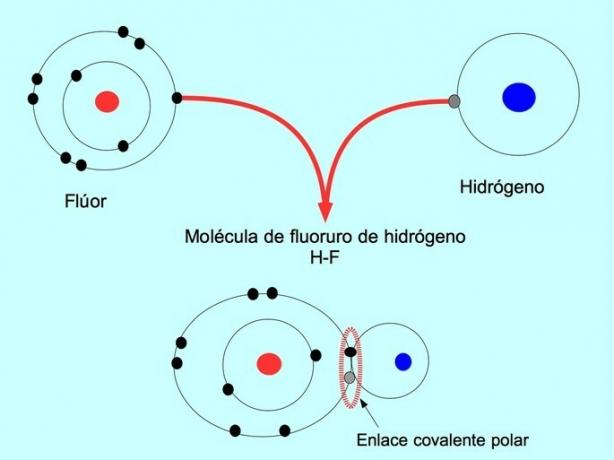
Απλός ομοιοπολικός δεσμός
Όταν δύο άτομα μοιράζονται δύο ηλεκτρόνια, ένα από κάθε ένα, ο ομοιοπολικός δεσμός που σχηματίζεται ονομάζεται απλός ομοιοπολικός δεσμός.
Για παράδειγμα, το χλώριο είναι ένα άτομο που έχει επτά ηλεκτρόνια σθένους στο εξωτερικό κέλυφος του, το οποίο μπορεί να γεμίσει με οκτώ ηλεκτρόνια. Ένα χλώριο μπορεί να συνδυαστεί με ένα άλλο χλώριο για να σχηματίσει το μόριο χλωρίου Cl2 που είναι πολύ πιο σταθερό από τα χλώρια μόνο.
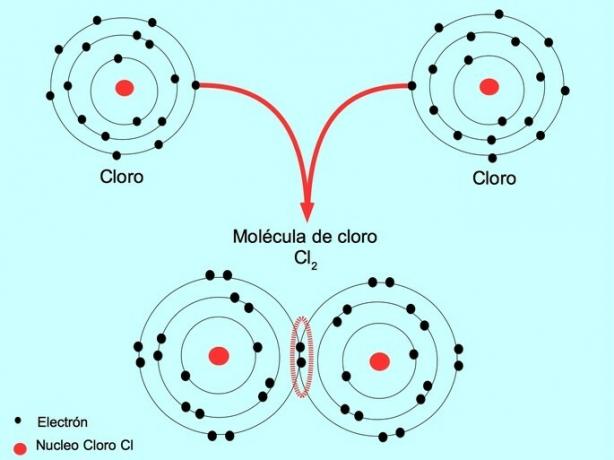
Διπλός ομοιοπολικός δεσμός
Ο διπλός ομοιοπολικός δεσμός είναι ο δεσμός όπου τέσσερα ηλεκτρόνια (δύο ζεύγη) ηλεκτρονίων μοιράζονται μεταξύ δύο ατόμων. Για παράδειγμα, το οξυγόνο έχει 6 ηλεκτρόνια στο τελευταίο του κέλυφος. Όταν συνδυάζονται δύο οξυγόνα, μοιράζονται τέσσερα ηλεκτρόνια μεταξύ των δύο, με αποτέλεσμα το καθένα να έχει 8 ηλεκτρόνια στο τελευταίο κέλυφος.
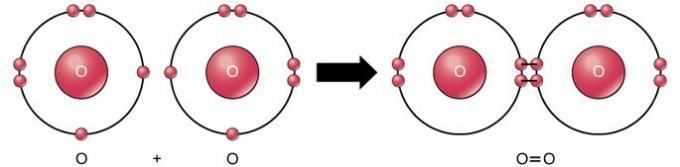
Τριπλός ομοιοπολικός δεσμός
Ο τριπλός ομοιοπολικός δεσμός σχηματίζεται όταν 6 ηλεκτρόνια (ή τρία ζεύγη) μοιράζονται μεταξύ δύο ατόμων. Για παράδειγμα, στο μόριο υδροκυανίου HCN, σχηματίζεται τριπλός δεσμός μεταξύ άνθρακα και αζώτου, όπως φαίνεται στο παρακάτω σχήμα:
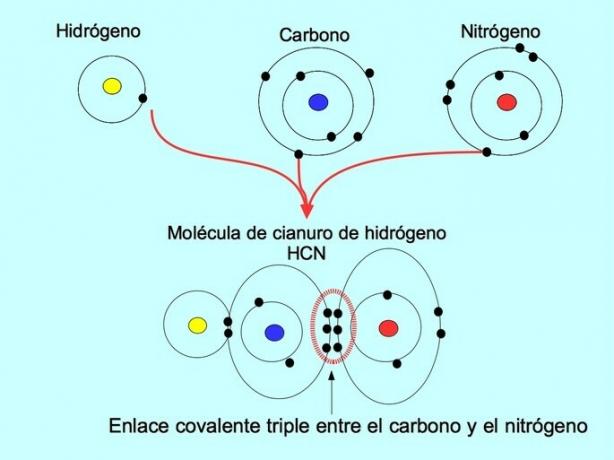
Συντεταγμένος ή γενικός ομοιοπολικός δεσμός
Ο συντονισμένος ή αφαιρετικός ομοιοπολικός δεσμός είναι ο δεσμός που σχηματίζεται όταν μόνο ένα από τα άτομα του δεσμού συνεισφέρει ένα ζεύγος ηλεκτρονίων. Για παράδειγμα, όταν αντιδρά η αμμωνία NH3 με τριφθοριούχο βόριο BF3, Το άζωτο συνδέεται με δύο ηλεκτρόνια απευθείας στο βόριο, το οποίο δεν διαθέτει διαθέσιμα ηλεκτρόνια για κοινή χρήση. Με αυτόν τον τρόπο, τόσο το άζωτο όσο και το βόριο αφήνονται με 8 ηλεκτρόνια στο κέλυφος σθένους τους.
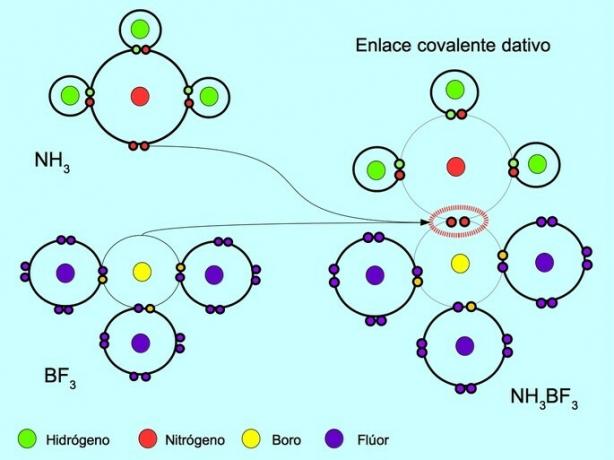
Δείτε επίσης Οργανικές και ανόργανες ενώσεις.
Διαμοριακοί σύνδεσμοι
Τα μόρια συνδέονται μέσω δυνάμεων που καθιστούν δυνατή τη δημιουργία ουσιών σε υγρή ή στερεή κατάσταση.
Δίπολοι-δίπολοι δεσμοί ή δυνάμεις
Αδύναμοι διαμοριακοί δεσμοί μπορούν να δημιουργηθούν μεταξύ πολικών μορίων όταν οι αρνητικοί πόλοι έλκονται σε θετικούς πόλους και αντίστροφα. Για παράδειγμα, το μεθανικό Η2Το C = O είναι ένα πολικό μόριο, με μερικό αρνητικό φορτίο στο οξυγόνο και μερικό θετικό φορτίο στα υδρογόνα. Η θετική πλευρά ενός μορίου μεθανίου προσελκύει την αρνητική πλευρά ενός άλλου μορίου μεθανίου.
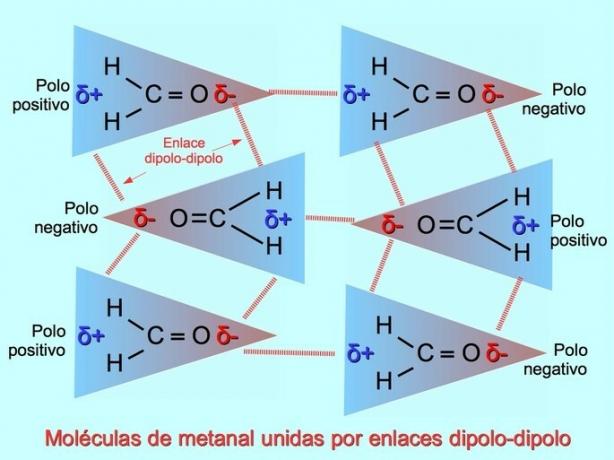
Δεσμοί υδρογόνου ή δεσμοί
Ο δεσμός υδρογόνου ή ο δεσμός υδρογόνου είναι ένας δεσμός που δημιουργείται μεταξύ των μορίων. Εμφανίζεται όταν ένα υδρογόνο στο μόριο συνδέεται ομοιοπολικά με ένα οξυγόνο, ένα άζωτο ή ένα φθόριο. Το οξυγόνο, το άζωτο και το φθόριο είναι άτομα με υψηλότερη ηλεκτροαρνητικότητα, επομένως προσελκύουν ηλεκτρόνια πιο έντονα όταν τα μοιράζονται με ένα άλλο λιγότερο ηλεκτροαρνητικό άτομο.
Υπάρχουν δεσμοί υδρογόνου μεταξύ των μορίων νερού Η2Ο και αμμωνία NH3 όπως δείχνει η εικόνα:
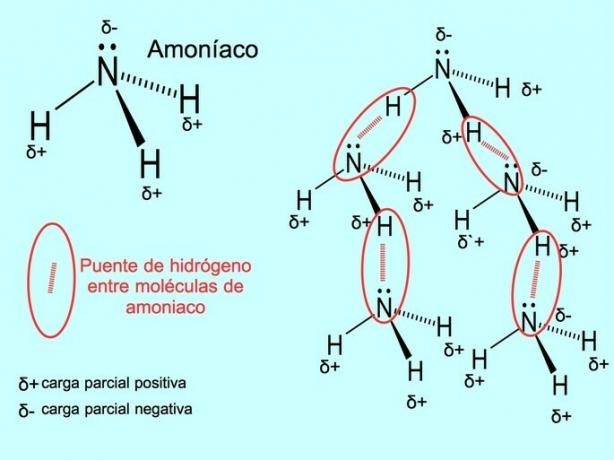
Μπορεί να σας ενδιαφέρει να δείτε:
- Άτομα και μόρια.
- Παραδείγματα οργανικών και ανόργανων ενώσεων.
- Μέταλλα και μη μέταλλα
βιβλιογραφικές αναφορές
Zumdahl, S.S., Zumdahl, S.A. (2014) Χημεία. Ένατη έκδοση. Μπρουκς / Κόουλ. Μπέλμοντ.
Commons, C., Commons, P. (2016) Χημεία Heinemann 5η έκδοση. Πέρσον Αυστραλία. Μελβούρνη.