Διαφορά μεταξύ ενδοθερμικών αντιδράσεων και εξωθερμικών αντιδράσεων
ΕΝΑ ενδοθερμική αντίδραση απαιτεί ισχύ ενώ a εξώθερμη αντίδραση απελευθερώνει ενέργεια. Αυτή η ταξινόμηση των χημικών αντιδράσεων λαμβάνει υπόψη τη συμμετοχή της ενέργειας είτε ως αντιδραστήριο είτε ως προϊόν.
Η ενέργεια είναι η ικανότητα να δουλεύει ή να παράγει θερμότητα. Να θυμάστε ότι οι χημικές αντιδράσεις περιλαμβάνουν αναδιάταξη ατόμων μεταξύ ουσιών με θραύση ή σχηματισμό χημικών δεσμών. Γενικά, αυτός ο σχηματισμός ή η διάσπαση των χημικών δεσμών συνοδεύεται από αλλαγές στην ενέργεια του συστήματος.
| Ενδοθερμική αντίδραση | Εξωθερμική αντίδραση | |
|---|---|---|
| Ορισμός | Χημική αντίδραση όπου απορροφάται η ενέργεια. | Χημική αντίδραση όπου η ενέργεια απελευθερώνεται με τη μορφή θερμότητας. |
| Προέλευση της ενέργειας | Του περιβάλλοντος | Του συστήματος |
| Δυναμική ενέργεια | Χαμηλότερο σε αντιδρώντα παρά σε προϊόντα. | Υψηλότερη στα αντιδρώντα παρά σε προϊόντα. |
| Παραγωγή | Όχι αυθόρμητο | Αυθόρμητος |
| Εσωτερική αλλαγή ενέργειας | ΔΕ> 0; εσωτερική ενεργειακή αλλαγή μεγαλύτερη από το μηδέν. | ΔΕ <0; η εσωτερική ενέργεια αλλάζει λιγότερο από το μηδέν. |
| Θερμοκρασία | Μειώνεται | Αυξάνεται |
| Παραδείγματα | Αντιδράσεις στη φωτοσύνθεση και τη σύνθεση γενικά. | Ένας αγώνας καύσης, αντιδράσεις καύσης. |
Τι είναι η ενδοθερμική αντίδραση;
Μια χημική αντίδραση είναι ενδοθερμική όταν απορροφά ενέργεια από το περιβάλλον. Σε αυτήν την περίπτωση, η θερμότητα μεταφέρεται από το εξωτερικό στο εσωτερικό του συστήματος. Όταν τοποθετούμε ένα θερμόμετρο ενώ λαμβάνει χώρα η ενδοθερμική αντίδραση, η θερμοκρασία μειώνεται.
Η λέξη "ενδοθερμική" προέρχεται από τα ελληνικά ενδόν που σημαίνει "μέσα" και θερμ που σημαίνει "θερμότητα". Οι ενδοθερμικές αντιδράσεις δεν προχωρούν αυθόρμητα.
Από πού προέρχεται η ενέργεια σε ενδοθερμικές αντιδράσεις;
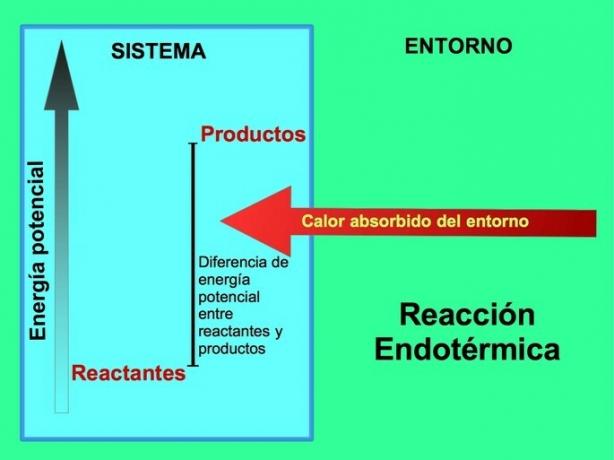
Στις ενδοθερμικές αντιδράσεις η ενέργεια προέρχεται από το περιβάλλον έξω από το σύστημα. Η ποσότητα πιθανής ενέργειας των προϊόντων είναι μεγαλύτερη από τη δυνητική ενέργεια των αντιδρώντων. Επομένως, είναι απαραίτητο να προστεθεί ενέργεια στα αντιδραστήρια για να προχωρήσει η αντίδραση. Αυτή η ενέργεια προέρχεται από τη θερμότητα του περιβάλλοντος.
Για παράδειγμα, η φωτοσύνθεση είναι μια ενδοθερμική διαδικασία, όπου τα φυτά συλλαμβάνουν ηλιακή ενέργεια για την παραγωγή γλυκόζης από διοξείδιο του άνθρακα και οξυγόνο:

Τα προϊόντα της αντίδρασης φωτοσύνθεσης, γλυκόζης και οξυγόνου, έχουν μεγαλύτερη ποσότητα πιθανής ενέργειας σε σχέση με τα αντιδραστήρια, το διοξείδιο του άνθρακα και το νερό. Άλλα παραδείγματα ενδοθερμικών χημικών αντιδράσεων με την ποσότητα ενέργειας που χρησιμοποιείται:

Παραδείγματα ενδοθερμικής αντίδρασης
Δεν συμβαίνουν μόνο αντιδράσεις στο εργαστήριο χημείας. Σε καθημερινή βάση, βρίσκουμε επίσης καταστάσεις όπου εμφανίζονται ενδοθερμικές αντιδράσεις.
Μαγειρεύοντας φαγητό
Αν και δεν φαίνεται να μοιάζει, η διαδικασία μαγειρέματος φαγητού είναι ενδοθερμική. Για να καταναλώνουμε ορισμένα τρόφιμα, πρέπει να παρέχουμε θερμότητα.
Στιγμιαία κρύα τσάντα
Τα κρύα πακέτα που χρησιμοποιούνται για τη θεραπεία προσκρούσεων ή διαστρέμματος γεμίζουν με νερό, αλλά όταν ανακινείται ή χτυπιέται, μια κάψουλα που περιέχει νιτρικό αμμώνιο σπάει μέσα. Η ανάμιξη νιτρικού αμμωνίου με νερό είναι μια ενδοθερμική αντίδραση, προκαλώντας την ψύξη του σάκου.
Μπορεί να σας ενδιαφέρει να δείτε το Διαφορά μεταξύ θερμότητας και θερμοκρασίας.
Τι είναι μια εξώθερμη αντίδραση;
ΕΝΑ Η εξώθερμη αντίδραση είναι εκείνη όπου η ενέργεια ρέει έξω από το σύστημα. Αυτή η ενέργεια απελευθερώνεται με τη μορφή θερμότητας, οπότε η τοποθέτηση θερμομέτρου στο σύστημα αντίδρασης αυξάνει τη θερμοκρασία.
Η λέξη "εξώθερμος" σχηματίζεται από εξω που σημαίνει "προς τα έξω" και θερμές, που σημαίνει "θερμότητα". Οι εξωθερμικές αντιδράσεις μπορεί να εμφανιστούν αυθόρμητα και, σε ορισμένες περιπτώσεις, να είναι εκρηκτικές, όπως ο συνδυασμός αλκαλικών μετάλλων και νερού.
Από πού προέρχεται η ενέργεια σε εξωθερμικές αντιδράσεις;
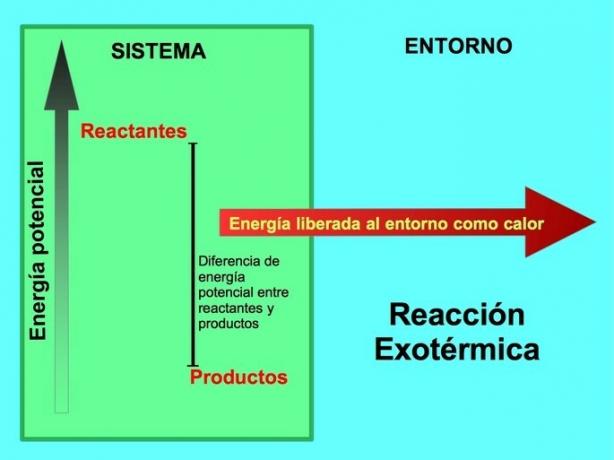
Σε μια χημική αντίδραση, τα αντιδραστήρια είναι οι ενώσεις που μετασχηματίζονται και δημιουργούν προϊόντα. Για παράδειγμα, όταν το νάτριο Na αντιδρά με χλώριο Cl, αυτά είναι τα αντιδραστήρια και το προϊόν είναι χλωριούχο νάτριο NaCl:

Τόσο τα αντιδραστήρια όσο και τα προϊόντα έχουν αποθηκεύσει πιθανή ενέργεια. Ξέρουμε από το lεξοικονόμηση ενέργειας ey ότι η ενέργεια δεν χάνεται ούτε αποκτάται, οπότε η ενέργεια των αντιδρώντων πρέπει να είναι ίση με εκείνη των προϊόντων.
Σε μια εξώθερμη αντίδραση, lτα αντιδραστήρια έχουν περισσότερη δυνητική ενέργεια σε σύγκριση με τα προϊόντα, έτσι η υπερβολική ενέργεια απελευθερώνεται ως θερμότητα. Σε αυτήν την περίπτωση, η ενέργεια θεωρείται επίσης ως μέρος των προϊόντων:

Σε οποιαδήποτε εξώθερμη διαδικασία, μέρος της πιθανής ενέργειας που αποθηκεύεται σε χημικούς δεσμούς μετατρέπεται σε θερμική ενέργεια μέσω θερμότητας.
Παραδείγματα εξωθερμικής αντίδρασης
Απορρυπαντικό πλυντηρίου
Όταν διαλύουμε μια μικρή σκόνη πλυσίματος με νερό στα χέρια μας, μπορούμε να αισθανθούμε μια ελαφριά θέρμανση.
Καύση οικιακού αερίου
Η καύση αερίων για οικιακή χρήση, όπως μεθάνιο ή βουτάνιο, περιλαμβάνει τη χημική αντίδραση με οξυγόνο με το σχηματισμό διοξειδίου του άνθρακα και νερού και την απελευθέρωση ενέργειας. Αυτή είναι μια τυπική εξώθερμη αντίδραση στην καθημερινή χρήση:
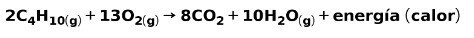
Η ενέργεια που απελευθερώνεται κατά τη διαδικασία καύσης χρησιμοποιείται για το μαγείρεμα φαγητού.
Μπορεί επίσης να σας ενδιαφέρει να μάθετε τι είναι Ανοιχτό σύστημα, κλειστό σύστημα και απομονωμένο σύστημα.