PERIOODILISE TABELI areng: selle loomisest tänapäevani
Perioodiline tabel on üks järgmistest kõige ikoonilisemad ikoonid teaduse. Kuigi 2019. aastal oli selle loomise 150. aastapäev, pole see sugugi valmis dokument. Selles ÕPETAJA õppetükis näeme, mida perioodilise tabeli areng alates selle loomisest kuni tänapäevani ja millised edusammud aatomite ja nende omaduste tundmisel on selle võimaldanud.
Indeks
- Mis on perioodiline tabel?
- Esimene perioodiline tabel: päritolu
- Perioodilise tabeli ajalugu ja areng
Mis on perioodiline tabel?
The perioodilisustabel Perioodiline elementide süsteem on teaduslik dokument, mis koondab rohkem teavet vähemasse ruumi ja moodustab teaduse ühe võimsama ikooni. See sisaldab head osa teadmised, mis meil keemias on. Üheski teises teadusvaldkonnas pole sarnast dokumenti.
Elementide perioodiline tabel on a keemiliste elementide klassifitseerimissüsteem See sai alguse enam kui 200 aastat tagasi. See klassifitseerimissüsteem on aja jooksul kasvanud ja muutunud, kuna teadus edenes ja avastati uusi
keemilised elemendid. Erinevad modifikatsioonid on siiski sisse viidud, hoides selle põhistruktuuri puutumatuna.Perioodiline tabel on nii nimetatud, kuna väljendab graafiliselt viis, kuidas nad korrapäraste ajavahemike järel kordavad keemilised omadused. See on teatud tüüpi kahemõõtmeline kujutis või moodsamates esitustes kolmemõõtmeline.
Aastal klassikaline perioodiline tabel (kahemõõtmeline) keemilised elemendid on paigutatud rühmadele või peredele ja on esindatud praeguses perioodilisustabelis vertikaalsetes veergudes. Nende rühmade järjestatud järjestus veergudes tekitab ridade rea, mida nimetatakse perioodideks, kus elemendid on järjestatud vastavalt nende aatomkaalule. Perioodiline tabel koosneb seitsmest erineva pikkusega perioodist.

Esimene perioodiline tabel: päritolu.
Enne Mendelejevit olid teised teadlased välja töötanud keemiliste elementide klassifitseerimissüsteemid. Kuid erinevalt elementide perioodilisest tabelist need olid pelgalt nimekirjad teadaolevatest elementidest; samas kui perioodilisustabelil on eripära, et see on kahemõõtmeline klassifikatsioonisüsteem (read ja veerud) või kolm mõõdet kõige moodsamates versioonides, kus keemilised elemendid on järjestatud kihid.
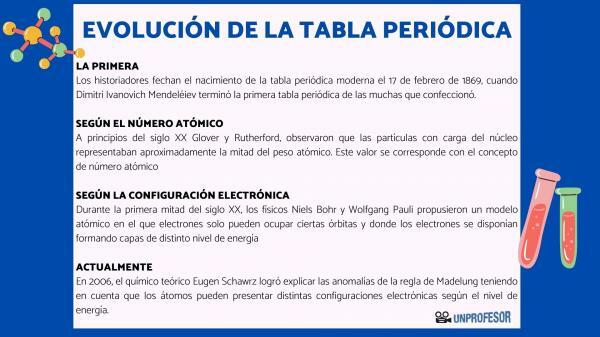
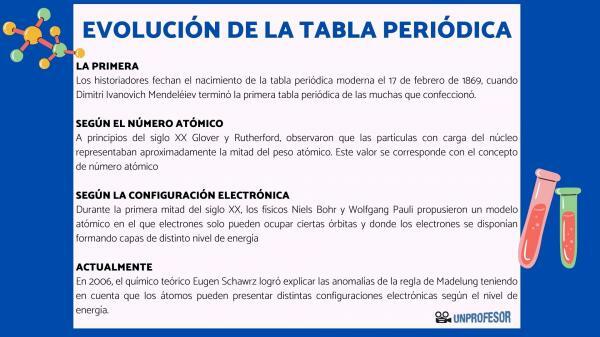
Sel põhjusel dateerivad ajaloolased tänapäevase perioodilise tabeli sündi 17. veebruar 1869, millal Dimitri Ivanovitš Mendelejev lõpeta esimene perioodiline tabel paljudest, mis ta tegi. See tabel koosnes 63 elemendist, mis on paigutatud perekondadesse ja jättis tühjad kohad elementidele, mida veel pole avastatud, kuid millest ta oli järeldanud nende aatommassi (nagu näiteks gallium, germaanium ja Skandium)
Perioodilise tabeli avastamise põhiandmed olid varasemad teadmised aatommass iga elemendi kohta.
Mis on aatommass ja aatomnumber?
See number kujutas aatomi kaalu ja see oli ainus mõõdetav väärtus aatomid. Kuid mitte mingil juhul ei tehtud otseseid mõõtmisi (puuduvad mõõteseadmed, mis võimaldaksid isoleeritud aatomite kaalumist), vaid need olid süsteem, mis standard, milles vesinikuaatomile anti meelevaldne väärtus 1 ja ülejäänud elementide aatommassi väärtus arvutati selle alusel Muster.
Esimesed arvutused aatomnumber elementidest viis läbi inglise keemik John Daltonja tekitas 19. sajandi esimesel poolel suure teadusliku arutelu. Kuid 19. sajandi teisel poolel oli elementide aatommasside arvutamise süsteemi osas juba märkimisväärne üksmeel. Aatomimass muutus alates Mendelejevist, mis on põhikriteerium perioodiliste tabelite elementide korrektseks järjestamiseks.
Kui Mendelejev tellis teadaolevad elemendid nende järgi suurenev aatommass, täheldas korduvate omaduste ilmnemist, mis võimaldas elemente grupeerida üksteisega sarnaste elementide rühmadesse või perekondadesse. Mõnel juhul ei reageerinud elementide järjestus nende aatomkaalu järgi täheldatud elementide sarnasustele ja Mendelejev muutus 17 elemendi paiknemine perioodilisustabeli paigutuses vaatamata nende aatommassile, et oleks võimalik neid rühmitada nende elementidega, millega nad esitasid analoogiaid.
Need muudatused näitasid, et mõned aktsepteeritud aatommassid ei olnud õiged ja need arvutati ümber. Hoolimata aatommasside korrektsioonidest, oli siiski elemente, mis tuli asetada muudesse positsioonidesse kui need, mida nende aatommassid näitasid.

Pilt: BBC.com
Perioodilise tabeli ajalugu ja areng.
Hoolimata Mendelejevi kahtlemata panusest ei ole elementide perioodiline tabel ühe uurija töö tulemus. Lisaks Mendelejevile olid XIX sajandi teisel poolel ja kogu kahekümnendal sajandil paljud Keemikud jätkasid keemiliste elementide kohta teabe korraldamise parima viisi uurimist teatud. Veelgi enam, arvestades, et selle aja jooksul avastati uued keemilised elemendid või lihtsad ained, tänu spektromeetriale (mis uurib aatomite ja elektromagnetkiirguse vastastikust mõju).
The elementide klassifikatsioon perioodilises tabelis põhines algselt aatommassid elementidest ja paljastasid analoogiad, mis võimaldasid elemente grupeerida analoogsetesse perekondadesse. Isegi nii ei olnud nende perioodiliste omaduste ilmnemise põhjust võimalik seletada. See oli kogu 20. sajandi jooksul koos elektroonilise struktuuri avastamisega, kui saadi aru selle elementide omaduste perioodilisuse põhjusest.
Aatomnumber sortimisjärjestusena
20. sajandi alguses Glover ja Rutherford, täheldas, et tuumas olid laetud osakesed umbes pool aatomimassist. See väärtus vastab kontseptsioonile aatomnumber mis on määratletud kui prootonite arv aatomituumas ja mis langeb kokku neutraalse aatomi elektronide arvuga. See uus väärtus õigustas teatud elementide positsiooni muutusi, mis seni olid läbi viidud. Näiteks positsiooni muutus telluuri ja joodi vahel.
1913. aastal Henry Moseley kinnitas röntgenspektromeetria abil tabeli järjestust aatomnumbri funktsioonina. Aatomnumbri järgi järjestamine kehtib ka tänapäeval.
Samal ajal avastati 20. sajandil uusi keemilisi elemente tänu kvantmehaanikale ja aatomite pommitamine osakeste abil, sajandi teisest poolest. Selle uue tehnika abil oli võimalik luua kunstlikud elemendid mida looduses pole.
Ehkki perioodilisustabeli elementide õiges paigutuses on tehtud edusamme, on siiski teatud omaduste korduva esinemise põhjus (omadused perioodiline). Programmi areng kvantmehaanika (füüsika haru, mis uurib valguse ja aatomite käitumist mikroskoopilises skaalas) 1920. aastast oli nende omaduste põhjuse selgitamiseks otsustav.
Elektrooniline konfiguratsioon perioodiliste omaduste selgitusena
20. sajandi esimesel poolel füüsikud Niels Bohr Y Wolfgang Pauli nad pakkusid välja aatomimudeli, milles elektronid saavad hõivata ainult teatud orbiite ja kus elektronid on paigutatud, moodustades erineva energiatasemega kihte. Elektroonide jaotumise orbiitides erinevates kestades või energiatasandites tuntakse elektrooniline konfiguratsioon.
Elektronide paigutuse avastamine elektronkonfiguratsioonides oli põhiline omaduste perioodilisuse mõistmisel. perioodiline, kuna täheldati, et need omadused olid tihedalt seotud aatomite (aatomi kihi) äärmise elektroonilise konfiguratsiooniga Valencia).
Järjestuse, milles elektronid aatomorbitaale täidavad, kehtestas 1930. aastal füüsik Erwin Madelung, kes kehtestas täitmise järjekorra jaoks arvulise reegli. See reegel on tuntud kui Madelungi reegel ja see on empiiriline reegel, mida ei saa kvantmehaanika abil seletada.
Perioodilisustabeli kolme esimese rea täitmine on lihtne, kuid tabelis neljas rida, kus asuvad üleminekuelemendid, läbib täitmise järjekorra rea muudatused. Kokku on 20 anomaalset üksust, mis seda reeglit ei järgi.
Tabeli areng jätkub täna
2006. aastal teoreetiline keemik Eugen Schawrz Tal õnnestus selgitada Madelungi reegli anomaaliaid, võttes arvesse, et aatomitel võib olla erinev elektrooniline konfiguratsioon sõltuvalt energiatasemest. Keskmiste arvutamisel vastavad enamiku elementide elektronkonfiguratsioonid Madelungi reeglile.
Perioodiline tabel on 21. sajandil endiselt arutelu küsimus, ehkki selle järjestus või elektrooniline konfiguratsioon Elementide puhul on endiselt asjakohane seda järjestust ja elektroonilistes konfiguratsioonides täheldatud anomaaliaid selgitada a abil teooria.
Kui soovite lugeda rohkem artikleid, mis on sarnased Perioodilise tabeli areng - kokkuvõte, soovitame sisestada meie kategooria Aatom.
Bibliograafia
Erinevad autorid. (2019)Eriline: perioodiline tabel. Teadus ja teadus. Barcelona: Scientific Press S.A.


