Aatomi struktuur ja omadused

Pilt: SlidePlayer
Aatomid on osa meie maailmast. Kogu aine koosneb aatomitest, seega on oluline paremini mõista, millest need koosnevad ja mis on nende funktsioonid. Selles ÕPETAJA õppetükis räägime teile, mida aatomi struktuur ja omadused. Kui soovite rohkem teada osakeste kohta, millest kõik moodustavad, lugege seda artiklit edasi.
Indeks
- Mis on aatomid?
- Aatomi struktuur
- Aatomi peamised omadused
- Mis on isotoopid?
- Kuidas leiduvad aatomid looduses?
Mis on aatomid?
The aatom see on väikseim üksus, millesse ainet saab jagada kaotamata keemilisi omadusi, see tähendab keemilise elemendi omadusi. Aatom on pärit kõigest, mida on võimalik näha või katsuda, alates tähtedest kuni hommikuse hommikusöögini.
Kui jätta kõrvale selle keemiliste omaduste kadu, võime öelda, et aatom koosneb erinevatest osakestest, mida nimetatakse subatomaatseteks osakesteks. Subatoomilisi osakesi on kolme tüüpi -protonid, neutronid ja elektronid- erinevate omadustega.
Need osakesed rühmitatakse keemiliste elementide (hapnik, süsinik jne) moodustamiseks erinevates arvudes, kuid need jaotuvad alati fikseeritud struktuuri järgides.

Pilt: Google Sites
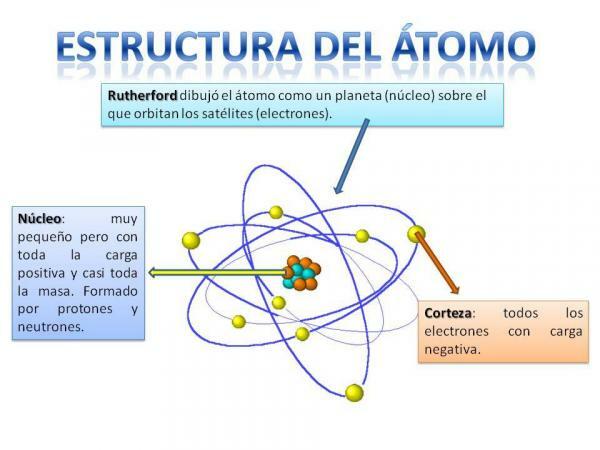
Aatomi struktuur.
Aatomi struktuur on fikseeritud, see tähendab, et meil võib olla erinevat tüüpi aatomeid (vesiniku aatom, hapniku aatom jne), kuid nende subatomaarsed osakesed on alati korraldatud sarnaselt planeedisüsteemile.
Mäletate kindlasti, kuidas Päikesesüsteem on korraldatud: Päike on keskel ja ümber sellest alates planeedid pöörlevad, kirjeldades erinevaid orbiite, ühed lähemale ja teised kaugemale Pühap. Aatomite puhul on keskel tuum, murakaga sarnase kujuga ja koosneb neutronid ja prootonid.
Tuuma ümber on Ajukoor mis on ala, mille kaudu elektronid. Varem arvati, et elektronid kirjeldavad teatud orbiite, sarnaselt planeetide tegevusele, ehkki nüüd nii on teab, et need orbiidid pole nii täpselt määratletud ja sarnanevad pigem piirkondadega, kuhu oleme tõenäolisemalt sattunud elektronid.
Pilt: REA - plaan Ceibal
Aatomi peamised omadused.
Selle aatomi struktuuri ja omaduste õpetuse jätkamiseks on oluline keskenduda elementidele, mis muudavad aatomi selliseks.
Ja selleks peame vastama sellele küsimusele: miks otsustavad kõik aatomid end sellisel viisil tellida? Vastus on lihtne: see on tingitud elektrilised atraktiivsed jõud. Aatomi tuum koosneb neutronitest, millel puudub elektrilaeng, ja prootonitest, millel on positiivne elektrilaeng. ja elektronidel on negatiivne elektrilaeng, mistõttu tuuma ja elektronide vahel on sarnane atraktiivne jõud toodetud magneti kahe pooluse vahel, kuid pole piisavalt tugev, et elektronid "langeksid" magnetile tuum.
Seda saab paremini mõista, kui võtame arvesse südamiku suurus: kui aatomil oleks näiteks jalgpallistaadioni mõõde, oleks tuuma keskel palli mõõde väljakult Kui palju atraktiivsust peaks jalgpall pakkuma, et staadioni pleegitajad sellele kukuksid!
Neutronite funktsioon
Nüüd võite mõelda ja millist rolli mängivad neutronid? Hoolimata elektrilaengu puudumisest, on neutronitel aatomis suur roll: nad annavad 99% massist. Kui see aitab teil meeles pidada, võime öelda, et aatom on nagu kolme sõbra jõuk: raske neutron, positiivne prooton ja negatiivne elektron, mis ümbritseb neutronit ja elektron.
Elektronide liikumine
Siinkohal tahan, et läheksime tagasi millegi juurde, mis meil oli tindipessa jäänud: orbiitidele, mida elektronid kirjeldavad tuuma ümber. Me olime seda öelnud elektronid pöörlevad tuuma ümber nagu planeedid teevad seda ümber Päikese, mõned lähemal kui teised, miks nad seda teevad? Elektronid pöörlevad ühes või teises kestas vastavalt energiale, mida nad peavad tuumast eemalduma, st tuumale lähemal asuvatel elektronidel pole piisav jõud tuumast eemaldumiseks, samal ajal kui kooriku kõige kaugemates kestades (orbitaalides) olijatel on rohkem energiat ja nad on suutnud tuumast kaugemale liikuda. tuum. Lisaks on igas orbitaalis maksimaalne võimsus 8 elektroni (okteti reegel).
Aatomi osakesed
Tuleme tagasi teise lähenemisviisi juurde, mida oleme varem teinud, kuid pole selgitanud: aatomid koosnevad neutronid, prootonid ja elektronid, mis ühendavad alati sama tuuma ja kooriku struktuuri, kuid teevad seda erineval hulgal, moodustades erinevad keemilised elemendid. Kuidas saada nii palju elemente, mis ühendavad ainult kolme tüüpi osakesi? Keemilisi elemente, mida olete kunagi näinud perioodilisustabelis, iseloomustab teatud aatomnumber.
The aatomnumber (Z) See ütleb meile prootonite arvu seda tüüpi aatomi tuumas, mis võrdub elektronide arvuga normaalsetes tingimustes. Nii näiteks on kõik aatomid, millel on 6 prootonit (Z = 6), süsinikuaatomid ja neil on samad keemilised omadused; 5 prootoniga aatomid (Z = 5) on booriaatomid, millel on üksteisega samad keemilised omadused ja mis erinevad süsinikuaatomite omadest. Te ei pea segi ajama aatomnumbrit aatommassiga või massinumber (A), mis on neutronite ja prootonite massi summa (elektronide kaal on kogu tuuma massi suhtes tühine).

Pilt: SlidePlayer
Mis on isotoopid?
Looduses võime leida erinevaid elementide "alamtüüpe" isotoopid. Olen kindel, et olete mingil hetkel kuulnud süsinikust 14 - süsiniku radioaktiivsest isotoopist, mida kasutatakse muu hulgas fossiilide vanuse määramiseks. Isotoopid on kaks aatomit sama arvu prootonitega (sama aatomnumber), kuid erinev neutronite arv (erinev aatommass). Sama elemendi isotoope nimetatakse tavaliselt elemendi nimega, millele järgneb selle aatommass.
Meie näites on mõlemad isotoopid süsinikud, seega on nende aatomnumber 6 (Z = 6), kuid süsinik 12 (“tavaline” süsinik) on aatommass 12 süsiniku 14 aatommassist 14. Sama elemendi isotoopidel on väga sarnased keemilised ja füüsikalised omadused. Süsiniku 14 puhul on erinevalt süsinikust 12 radioaktiivne isotoop, mida leidub kõigis süsinikku sisaldavates elementides, sealhulgas elusolendites.
Sellega lõpetame selle aatomi struktuuri ja omaduste tunde. Loodame, et sellest on teile abi olnud.

Pilt: teie ülesanded
Kuidas leiduvad aatomid looduses?
Aatomeid võib leida eraldi, kuid kõige normaalsem on nende leidmine kombineerituna rühmadena helistas molekulid.
Molekulid võivad koosneda sama elemendi aatomitest (näiteks hapniku molekul, mis koosneb kahest hapnik) või rühmade kaupa, kus erinevate elementide aatomid (kaks vesiniku aatomit ja üks hapniku aatom moodustavad molekuli Vesi). Neid elementide rühmi nimetatakse molekulideks, mida omakorda saab omavahel kombineerida ja moodustades järjest keerukamaid rühmitusi vastavalt nende reaktiivsusele ja keemilisele afiinsusele allikas keemilised lingid.
Kui soovite lugeda rohkem artikleid, mis on sarnased Aatomi struktuur ja omadused, soovitame sisestada meie kategooria Aatom.


