Mis on LÄMMASTIKU VALENTSID

Lämmastik on meie elus väga oluline keemiline element, Nii heas kui halvas. See on peamine gaas atmosfääris, seda leidub pinnases ja see on enamiku elusolendite jaoks väga oluline makromolekul. Samuti on see osa suure tööstusliku tähtsusega ühenditest, nagu ammoniaak, raketikütused või lõhkeained.
Mis juhtub, on see, et selle valents ja oksüdatsiooniaste on olenevalt ühendist erinev. Selles ÕPETAJA õppetunnis räägime sellest millised on lämmastiku valentsid. Kui olete huvitatud selle keemilise elemendi tundmaõppimisest, siis see artikkel meeldib teile!
Indeks
- Mis on lämmastik ja omadused
- Millised on lämmastiku valentsid?
- Lämmastikuühendite nomenklatuur
- Olulised lämmastikuühendid
- Lämmastiku mõju tervisele
- Lämmastiku mõju keskkonnale
Mis on lämmastik ja omadused.
Lämmastik on keemiline element sümboliga N. aatomarvuga 7, aatommassiga 14,0067 ja tavatingimustes leitud gaasilises olekus. Molekulaarne lämmastik moodustab 78% kuiva õhu mahust ja on seetõttu peamine atmosfääris leiduv gaas.
See kõrge lämmastiku kontsentratsioon atmosfääris tuleneb elektrilisest tegevusest atmosfääris, õhulämmastiku fikseerimisest bakteriaalne toime, keemiline toime tööstuses ja lämmastiku eraldumine orgaanilise aine lagunemise või põlemine. Kombineeritud olekus moodustavates ühendites leidub lämmastikku erinevates olekutes.
See on elusolendite jaoks suure tähtsusega element, kuna See on osa kõigist valkudest nii taimsed kui loomsed ja paljud teised orgaanilised ühendid. Lämmastik moodustab tugevad sidemed teiste aatomitega, nagu lämmastik ja teised, tänu oma võimele moodustada kolmiksidemeidSeetõttu on lämmastikuühenditel palju energiat.
Lämmastik koosneb kaks isotoopi:
- N14 (väga enamus)
- N15 ja mitmesugused radioaktiivsed isotoobid, mis tekivad tuumareaktsioonide käigus.
See on element, mis pakub suurt huvi keemiatööstuses ja põllumajanduses kasutatavates ühendites. Seda kasutatakse ka hõõglambi pirnides ja kui on vaja suhteliselt inertset atmosfääri.
Lämmastik oma elementaarsel kujul reageerib tavatemperatuuril kõige tavalisemate ainetega kergelt, kõrgendatud temperatuuril temperatuuridel reageerib see paljude ainetega, nagu titaan, alumiinium, räni, boor, berüllium, kaltsium, liitium või kroom, hapnikuga (O2) moodustavad kõrgel temperatuuril ja rõhul oksiide nagu dilämmastikoksiid (NO) ja vesinikuga, moodustades väga olulise tööstusliku ühendi, nagu näiteks ammoniaak.
Pildi allikas: Monographs.com
Millised on lämmastiku valentsid?
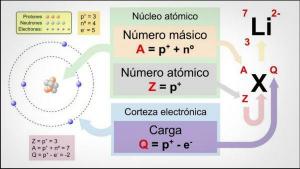
The keemilise elemendi valentsid kas ta on number alates elektronid mida on puudu või mida nad peaksid andma et täita oma viimane elektrooniline tase.
The aatomid neil tavaliselt on 7 taset või kihti kus elektronid asuvad, kusjuures 1 on kõige sisemine ja 7 on välimine. Omakorda on olemas erinevad alamtasandid, mida nimetatakse s, p, d ja f. Aatomis täidavad elektronid erinevaid tasandeid vastavalt oma energiatele, täites esmalt madalamad energiatasemed ja seejärel liikudes kõrgemale.
Et aatomi välimine tasand seda nimetatakse ka kui valents kest ja selles kestas paiknevaid elektrone nimetatakse valentselektronid. Need elektronid vastutavad sidemete moodustumise ja võimalike keemiliste reaktsioonide eest. koos teiste aatomitega, st nad on elektronid, mis vastutavad a füüsikaliste ja keemiliste omaduste eest element.
Erinevad viisid, kuidas lämmastik kombineeritakse, annavad sellele valentsi (tuntud ka kui oksüdatsiooniaste). Lämmastik ei ole võimeline oma valentskihti laiendama, nagu seda teevad teised selle rühma elemendid. Selle võimalikud valentsid on -3, +3 ja +5. Lämmastiku valents olek varieerub sõltuvalt ühendist, mille osa see on. Ka teistel lämmastikuperekonna elementidel on need oksüdatsiooniastmed ja need on fosfor (P), antimon (Sb), vismut (Bi), moskovium (Mc) ja arseen (As).
Keemiliste ühendite teket lämmastikuga saab seletada valentssidemete teooriat järgides, vastavalt lämmastiku iga oksüdatsiooniastme elektroonilisele konfiguratsioonile. Selle selgitamiseks võetakse arvesse elektronide arvu selle valentskihis ja seda, kui palju on puudu väärisgaasi elektroonilise konfiguratsiooni saavutamiseks.

Lämmastikuühendite nomenklatuur.
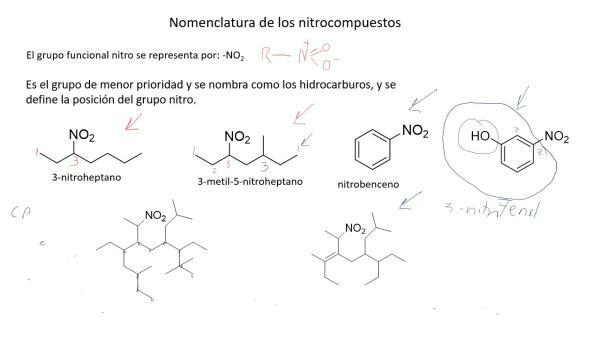
Lämmastikuühendid on keemiliselt keerulised ja traditsioonilisest nomenklatuurist ei piisanud nende lihtsaks nimetamiseks ja tuvastamiseks, nii et mille Rahvusvaheline Puhta ja Rakenduskeemia Liit (IUPAC) lõi (ka muude tegurite tõttu) a süstemaatiline nomenklatuur milles ühendeid nimetatakse neid moodustavate aatomite arvu järgi.
See nomenklatuur sobib eriti hästi lämmastikoksiidide nimetamiseks. Seega nimetatakse lämmastikoksiidi lämmastikmonooksiidiks ja dilämmastikoksiidiks (NO), dilämmastikoksiidiks (N2O).
Lisaks sellele nomenklatuurile 1919. aastal saksa keemik Alfred Stock töötas välja meetodi, mille abil ühendid nimetati sõltuvalt oksüdatsiooniastmest, kujutatud rooma numbritega ja sulgudes. Sel viisil kutsutaks lämmastikoksiidi lämmastikoksiidiks (II) ja dilämmastikoksiidiks lämmastikoksiidiks (I).
Pilt: Youtube
Olulised lämmastikuühendid.
Lämmastik on võimeline seonduma erinevate elementidega ja moodustama suure hulga ühendeid tänu oma suurele hulgale võimalikele oksüdatsiooniastmetele. Molekulaarse lämmastiku puhul on selle valents definitsiooni järgi 0.
Üks levinumaid oksüdatsiooniastmeid on -3. Selles oksüdatsiooniastmes moodustab lämmastik selliseid ühendeid nagu ammoniaak (NH3), ammooniumiioon (NH4-), nitriile (C≡N), imiine (C=N-R) või amiine (R3N). Kui lämmastik on oksüdatsiooniastmes -2, jääb selle valentskihti 7 elektroni. Paar elektronide arv selle valentskihis muudab kahe lämmastikuaatomi vahel sildsidemete tekkimise lihtsaks. Selles olekus moodustab lämmastik hüdrasoonid (C=N-N-R2) ja hedrasiinid (R2-N-N-R2). Oksüdatsiooniolekus -1 jääb valentskihti 6 elektroni ja tekivad sellised ühendid nagu hüdroksüülamiin (R2NOH) ja asoühendid (RN=NR).
Kui lämmastik saavutab positiivse oksüdatsiooniastme, Lämmastik seondub hapnikuaatomitega, moodustades oksiide, oksühappeid või oksüsooli. Oksüdatsiooniastmes +1 jääb lämmastik valentskestasse 4 elektroniga. Seega on meil näiteid nagu dilämmastikoksiid (N2O), mida rahvasuus tuntakse naerugaasina, ja lämmastikühendid (R=NO). +2 olekus on meil lämmastikoksiid ehk lämmastikoksiid (NO), mis on värvitu gaas, mis tekib metallide reaktsioonil lahjendatud lämmastikhappega. Sellel ühendil on väga ebastabiilne vaba radikaal, mis võib reageerida hapnikuga, moodustades olulise atmosfääri saasteaine, nagu lämmastikdioksiid (NO2)
+3 olekus tekivad aluselises lahuses (NO2–) sellised ühendid nagu nitrit. või lämmastikhape happelahuses (HNO2). Mõlemad on oksüdeerivad ained, mis võivad tekitada lämmastikoksiidi (NO) või olla redutseerivad ained nitraadiioonide moodustamisel. Teised ühendid on dilämmastiktrioksiid (N2O3) ja nitrorühm (R-NO2). +4 olekus on meil lämmastikdioksiid (NO2) või lämmastikdioksiid. See on pruuni värvi gaas, mis tekib paljude metallide reaktsioonil kontsentreeritud lämmastikhappega, moodustades lämmastiktetroksiidi (N2O4). +5 juures võime leida nitraate või lämmastikhapet, mis on happelahustes oksüdeerivad ained.
Lõpuks On ühendeid, milles lämmastik on erinevates oksüdatsiooniastmetes.. Need on sellised ühendid nagu nitrosilasiid või dilämmastiktrioksiid.
Pilt: Ambientum
Lämmastiku mõju tervisele.
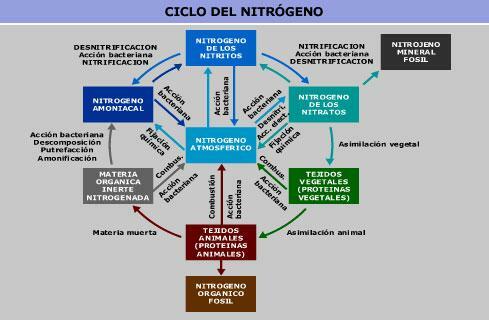
Molekulaarne lämmastik on atmosfäärigaasi peamine gaasiline komponent. Vees ja pinnases leiame seda nitraadi ja nitriti kujul. Kõik need ühendid on omavahel seotud lämmastikuringes.
Inimtegevus on muutnud nitraadi ja nitriti kontsentratsiooni maal, peamiselt nitraatidega sõnniku mulda laotamise kaudu. Veelgi enam, nitraatide ja nitritite kontsentratsioon pinnases ja vees suureneb tööstuse poolt lämmastikuringe kaudu eralduv lämmastik. See võib põhjustada ka lämmastikusisalduse suurenemist joogivees.
The nitraatide ja nitritite mõju inimeste tervisele need võivad olla:
- Nitraadid mõjutavad negatiivselt kilpnäärme aktiivsust
- Nitraadid vähendavad A-vitamiini ladestumist
- Nii nitraadid kui ka nitritid toodavad nitrosoamiine, mis on tavaline vähktõve põhjus
- Nitrit reageerib hemoglobiiniga, põhjustades vere hapniku kandevõime vähenemist.
- Lämmastikoksiid (NO) on inimkeha põhiline sõnumitooja, põhjustades lõõgastust lihaseid, kasu südame-veresoonkonna süsteemile või avaldades signaali mõju rakkudele immuunsussüsteem. Neid toimeid kasutatakse juba mitmetes meditsiinilistes rakendustes, nagu südameinfarkti ravimid või Viagra.
Lämmastiku mõju keskkonnale.
Nitraatide ja nitritite lisamine väetistele põhjustab nende keskkonnakontsentratsiooni suurenemist, samuti erinevad tööstuslikud protsessid. Paljud neist ühenditest võivad sattuda atmosfääri ja reageerida hapnikuga, tekitades atmosfääri saasteaineid, mis soodustavad kasvuhooneefekti suurenemist.
Nitraadid ja nitritid omakorda avaldavad kahjulikku mõju mageveele ja merekeskkonnale, mõjutab seda ökosüsteemi ja liike negatiivselt kes seda elavad. Samuti suurenevad nende lämmastikuühendite kontsentratsioonid joogivees drastiliselt, avaldades seega negatiivset mõju inimeste tervisele.
Kui soovite lugeda rohkem sarnaseid artikleid Millised on lämmastiku valentsid, soovitame teil sisestada meie kategooria Aatom.
Bibliograafia
- Mayz-Figueroa, J. (2004). Bioloogiline lämmastiku sidumine. UDO Agricultural Scientific Journal, 4 (1), 1-20.
- Celaya-Michel, H. ja Castellanos-Villegas, A. JA. (2011). Lämmastiku mineraliseerumine kuivade ja poolkuivade tsoonide pinnases. Terra Latinoamericana, 29(3), 343-356.
- Cárdenas-Navarro, R., Sánchez-Yáñez, J. M., Farías-Rodríguez, R. ja Peña-Cabriales, J. J. (2004). Lämmastiku sisendid põllumajanduses. Chapingo ajakirja Aiandussari, 10(2), 173-178.